题目内容
10.下列说法正确的是( )| A. | 将0.2 mol/L的一元酸HA溶液和0.1 mol/L的NaOH溶液混合,混合液中一定有:c(OH-)+c(A-)=c(H+)+c(Na+) | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-9mol/L,则该溶液的pH一定为5 | |
| C. | 室温下,NaHSO3溶液的pH<7,则溶液中c(SO32-)<c(H2SO3) | |
| D. | Na2CO3溶液与NaHCO3溶液混合一定有2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] |
分析 A.溶液呈电中性,存在电荷守恒,结合含有的离子进行判断;
B.该溶液可能是酸的溶液,也可能是盐的溶液;
C.室温下,NaHSO3溶液的pH<7,说明HSO3-的电离程度大于其水解程度;
D.由物料守恒可知,等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合中存在2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)].
解答 解:A.溶液呈电中性,由电荷守恒可得:c(OH-)+c(A-)=c(H+)+c(Na+),故A正确;
B.溶液中水电离的离子与氢氧根离子浓度相等,该溶液若是酸的溶液,溶液的pH为5,若是盐的溶液,该溶液的pH可能为9,故B错误;
C.室温下,NaHSO3溶液的pH<7,说明HSO3-的电离程度大于其水解程度,则c(SO32-)>c(H2SO3),故C错误;
D.由物料守恒可知,等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合中存在2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],但二者物质的量浓度不一定相等,故D错误.
故选:A.
点评 本题考查离子浓度大小比较、溶液pH计算等,注意对电荷守恒与物料守恒的理解,在离子浓度等量关系中经常利用.

练习册系列答案
相关题目
17.下列化学用语正确的是( )
| A. | H2S的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | S2-的结构示意图: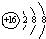 | |
| C. | Na2O2的电子式:Na+[$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$]2-Na+ | |
| D. | CCl4的电子式: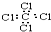 |
1. 用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
 用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )| A. | 选用酚酞作指示剂的滴定终点的判断:当浅红色变为无色且半分钟内仍为无色时即为滴定终点 | |
| B. | 滴定终点读数时,俯视滴定管的刻度(其他操作均正确),会造成测定结果偏低 | |
| C. | 甲滴定管中盛有H2SO4溶液,液面恰好在10.00mL刻度处,并把甲滴定管中的H2SO4溶液全部放入烧杯中,其体积为40.00mL | |
| D. | 量取15.00mLKMnO4溶液应选择乙滴定管 |
18.化学上为了方便,常将电离平衡常数的负对数称为pKa,即pKa=-lgKa,亚硫酸和碳酸的pKa数据如下:
(1)0.01mol/L NaHSO3溶液的pH=bl,0.01mol/L NaHCO3溶液的pH=b2,b1<b2(选填“<”、“>”、“=”).
(2)向10mL 0.01mol/L的H2SO3溶液中,滴加0.0lmol/L KOH溶液V(mL).
①当V=10mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)>c(OH-)(选填“<”、“>”、“=”).
②当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-),该溶液呈中性(选填“酸”、“中”、“碱”).当V=b mL时,溶液中离子浓度有如下关系:c(K+)=c(SO32-)+c(HSO3--)+c(H2SO3),该溶液呈酸性(选填“酸”、“中”、“碱”),则a>b(选填“<”、“>”、“=”).
| 物质 | H2SO3 | HSO3- | H2CO3 | HCO3- |
| PKa | 1.9 | 7.2 | 6.4 | 10.3 |
(2)向10mL 0.01mol/L的H2SO3溶液中,滴加0.0lmol/L KOH溶液V(mL).
①当V=10mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)>c(OH-)(选填“<”、“>”、“=”).
②当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-),该溶液呈中性(选填“酸”、“中”、“碱”).当V=b mL时,溶液中离子浓度有如下关系:c(K+)=c(SO32-)+c(HSO3--)+c(H2SO3),该溶液呈酸性(选填“酸”、“中”、“碱”),则a>b(选填“<”、“>”、“=”).
5.用阳极a和阴极b电解c的水溶液一段时间,然后加入d,能使溶液恢复到电解前状态,a、b、c、d正确组合是( )
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
15.若pH=2的酸溶液和pH=12的碱溶液等体积混合后溶液呈碱性,其原因可能( )
| A. | 反应后盐水解使溶液呈碱性 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液反应 |
2.下列的各组离子在酸性溶液中能大量共存的是( )
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ca2+、SO32-、ClO- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
19.二氧化碳的捕集、利用与封存是能源领域的一个重要研究课题
(1)在太阳能作用下,以CO2为原料制取碳(C)的流程如图1所示.
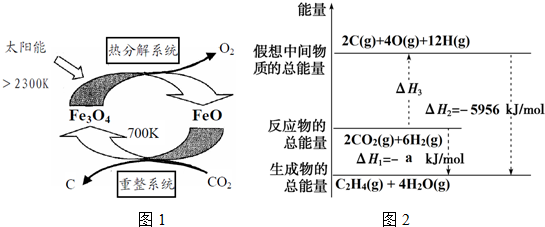
①热分解系统每分解0.5mol Fe3O4转移电子的物质的量为1mol.
②该系统的总反应的化学方程式是CO2═C+O2.
(2)二氧化碳催化加氢可合成低碳烯:
2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H1=-a kJ•mol-1,有关能量变化如图2所示:
①几种物质具有的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时放出或吸收的热量即为其具有的能量)如表所示:
则a=128
②几种化学键的键能如下:
则b=436
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图三所示.
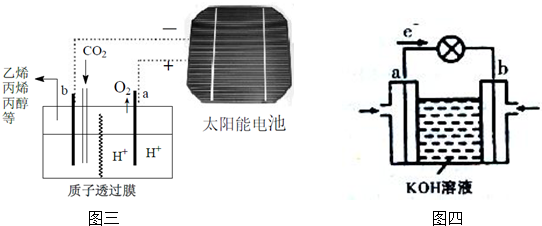
①该工艺中能量转化方式主要有太阳能转化为电能、电能转化为化学能(写出其中两种形式即可).
②其中b极上生成丙烯(CH3CH=CH2)的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
③乙烯和氧气反应通过上图四装置可将化学能转化为电能,b电极反应式为O2+2H2O+4e-=4OH-.
(1)在太阳能作用下,以CO2为原料制取碳(C)的流程如图1所示.

①热分解系统每分解0.5mol Fe3O4转移电子的物质的量为1mol.
②该系统的总反应的化学方程式是CO2═C+O2.
(2)二氧化碳催化加氢可合成低碳烯:
2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H1=-a kJ•mol-1,有关能量变化如图2所示:
①几种物质具有的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时放出或吸收的热量即为其具有的能量)如表所示:
| 物质 | CO2(g) | C2H4(g) | H2O(g) |
| 能量/kJ•mol-1 | -394 | 52 | -242 |
②几种化学键的键能如下:
| 化学键 | C=O | H-H | C=C | O-H |
| 键能/kJ•mol-1 | 803 | b | 615 | 463 |
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图三所示.

①该工艺中能量转化方式主要有太阳能转化为电能、电能转化为化学能(写出其中两种形式即可).
②其中b极上生成丙烯(CH3CH=CH2)的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
③乙烯和氧气反应通过上图四装置可将化学能转化为电能,b电极反应式为O2+2H2O+4e-=4OH-.
20.14号元素在周期表中的位置是( )
| A. | 第二周期IVA族 | B. | 第二周期VIA族 | C. | 第三周期IVA族 | D. | 第三周期VIA族 |