题目内容
11. Na2CO3和NaHCO3是两种常见的钠盐.
Na2CO3和NaHCO3是两种常见的钠盐.(1)下列关于Na2CO3和NaHCO3性质的说法中,正确的是d
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2的体积相同
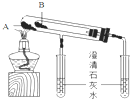
(2)实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:物质A是Na2CO3,写出实验中所发生的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)若要除去碳酸钠溶液中的少量碳酸氢钠,请用化学方程式表示除杂原理Na2CO3+CO2+H2O=2NaHCO3.
分析 (1)碳酸钠的溶解度大于碳酸氢钠;碳酸钠和碳酸氢钠溶液都呈碱性;氢氧化钙能够与碳酸钠、碳酸氢钠溶液反应生成碳酸钙沉淀;物质的量相等的碳酸钠和碳酸氢钠含有相同的C原子,根据碳原子守恒可知,物质的量越大,则生成二氧化碳的量越大,据此进行判断;
(2)套管实验时,为便于比较稳定度,易分解的物质应在小试管中;碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水;
(3)碳酸钠能够与二氧化碳反应生成碳酸氢钠,据此可除去碳酸氢钠溶液中的碳酸钠.
解答 解:(1)a.常温下,Na2CO3在水中的溶解度比NaHCO3大,故a错误;
b.碳酸钠的摩尔质量大于碳酸氢钠,则质量相等的二者,碳酸氢钠的物质的量较大,根据C原子守恒,盐酸足量时碳酸氢钠放出的二氧化碳较多,故b错误;
c.碳酸钠和碳酸氢钠都能够与氢氧化钙反应生成沉淀,不能Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液,故c错误;
d.根据碳原子守恒可知,等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2的体积相同,故d正确;
故答案为:d;
(2)套管实验时,为便于比较稳定度,易分解的物质应在小试管中,即B中加入NaHCO3,A中加入Na2CO3,从而说明NaHCO3能在较低温度下分解,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:Na2CO3;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)除去碳酸氢钠溶液中的碳酸钠,可向碳酸氢钠溶液中通入过量二氧化碳,将碳酸钠转化成碳酸氢钠,反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3,
故答案为:Na2CO3+CO2+H2O=2NaHCO3.
点评 本题考查碳酸钠、碳酸氢钠的性质,题目难度中等,侧重实验探究及装置的考查,明确碳酸钠、碳酸氢钠的性质及鉴别方法为解答关键,试题培养了学生的分析能力及化学实验能力.

| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2CO3?2H++CO32- | D. | A12(SO4)3═2A13++3SO42- |
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.请填写表中的空白:
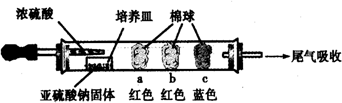
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
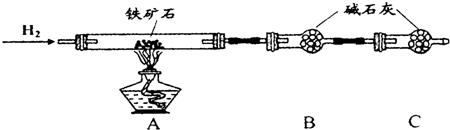
实验一:铁矿石中含氧量的测定
(1)按图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为24%.
实验二:铁矿石中含铁量的测定
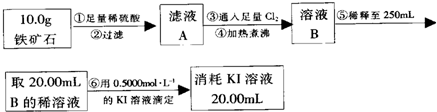
(1)步骤②和⑤中都要用到的玻璃仪器是烧杯、玻璃棒.
(2)下列有关步骤⑥的操作中说法不正确的是bc.
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为Fe5O6.
| A. | 甲原子最外层电子数比乙原子最外层电子数少 | |
| B. | 甲原子电子层数比乙原子电子层数多 | |
| C. | 1mol甲从酸中置换生成的氢气比1mol乙从酸中置换生成的氢气多 | |
| D. | 常温下,甲能与水反应生成氢气,而乙不能 |
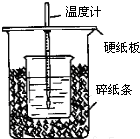 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
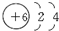 .
. 如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物,F为磁性物质.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物,F为磁性物质.它们存在如下转化关系,反应中生成的水及次要产物均已略去.