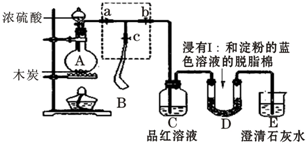
��Ŀ����
 ���û�ѧ��Ӧԭ���о�̼��������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壻
���û�ѧ��Ӧԭ���о�̼��������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壻��l���״�����Ҫ�Ŀ�����ȼ�ϣ���֪�ڳ��³�ѹ�£�
2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-1275.6kJ/mol
2CO��g��+O2��g��=2CO2��g����H=-566.0kJ/mol
H2O��g��=H2O��l����H=-44.0kJ/mol
��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ
��2�����ô�������Ӧ��ת��Ϊ�ǹ�ҵ����������Ĺؼ����裮
��һ�������£���SO2��O2�������2��1����һ���������ܱ������з���������Ӧ����˵���÷�Ӧ�Ѵﵽƽ��״̬����
a����ϵ���ܶȲ������仯
b����ϵ����Ԫ�ص������ٷֺ������ٱ仯
c��SO2��SO3������ȱ��ֲ���
d �����ڵ���������������ٱ仯
e����λʱ����ת��4mol���ӣ�ͬʱ����2molSO3
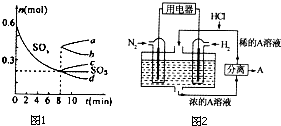
��T��ʱ����1L�ܱ������г���0.6molSO3��ͼ1��ʾSO3���ʵ�����ʱ��ı仯���ߣ��ﵽƽ��ʱ����SO2 ��ʾ�Ļ�ѧ��Ӧ����Ϊ
��3������������N2��H2Ϊ��Ӧ�������A���ʵ�ϡ����Ϊ�������Һ��������������ṩ���ܣ����̵ܹ�������ȼ�ϵ�أ�װ����ͼ2��ʾ����������ĵ缫��Ӧʽ��
���㣺���ʵ�����Ũ����ʱ��ı仯����,�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧƽ��״̬���ж�,��ѧƽ��ļ���,���ԭ��
ר�⣺��ѧƽ��ר��
��������1�����ݸ�˹���ɣ�����֪��Ӧ
�õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�����Ȼ�ѧ����ʽ��
��2���ٷ�Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ������Ҳ���䣬�Դ��жϣ�
�����ݻ�Ϊ1L�ܱ������г���0.6molSO3����ͼ1ƽ��ʱSO3���ʵ���Ϊ0.2mol��
2SO2+O2?2SO3��
��ʼ����mol�� 0 0 0.6
�仯����mol�� 0.4 0.2 0.4
ƽ������mol�� 0.4 0.2 0.2
ת����=
��100%������K=
���㣻�����������䣬��8minʱѹ�����������0.5L��ƽ��������Ӧ�����ƶ���n��SO3�����
��3�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ��������HCl��Ӧ�����Ȼ�泥���������ҺΪ�Ȼ�泥�
| ��-��+�ۡ�4 |
| 2 |
��2���ٷ�Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ������Ҳ���䣬�Դ��жϣ�
�����ݻ�Ϊ1L�ܱ������г���0.6molSO3����ͼ1ƽ��ʱSO3���ʵ���Ϊ0.2mol��
2SO2+O2?2SO3��
��ʼ����mol�� 0 0 0.6
�仯����mol�� 0.4 0.2 0.4
ƽ������mol�� 0.4 0.2 0.2
ת����=
| ������ |
| ��ʼ�� |
| c(SO 3) 2 |
| c(SO 2) 2c(O 2) |
��3�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ��������HCl��Ӧ�����Ȼ�泥���������ҺΪ�Ȼ�泥�
���
�⣺��1����֪����2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-1275.6kJ/mol
��2CO��g��+O2��g��=2CO2��g����H=-566.0kJ/mol
��H2O��g��=H2O��l����H=-44.0kJ/mol
��
�õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=[��-1275.6kJ/mol��-��-566.0kJ/mol��+��-44.0kJ/mol����4]��2=442.8kJ?mol-1��
��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ?mol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ?mol-1��
��2����a�������������䣬��ϵ���ܶȲ������仯������˵����Ӧ�ﵽƽ��״̬����a����
b�������������䣬SԪ���������䣬��ϵ����Ԫ�ص������ٷֺ������ٱ仯������˵����Ӧ�ﵽƽ��״̬����b����
c��SO2��SO3������ȱ��ֲ��䣬��˵����Ӧ�ﵽƽ��״̬����c��ȷ��
d �����ڵ���������������ٱ仯��˵�������ʵ�Ũ�Ȳ��䣬˵����Ӧ�ﵽƽ��״̬����d��ȷ��
e���κ�״̬�£���λʱ����ת��4mol ���ӣ�ͬʱ����2mol SO3������˵����Ӧ�ﵽƽ��״̬����e����
�ʴ�Ϊ��cd��
�����ݻ�Ϊ1L�ܱ������г���0.6molSO3����ͼ1ƽ��ʱSO3���ʵ���Ϊ0.2mol��
2SO2+O2?2SO3��
��ʼ����mol�� 0 0 0.6
�仯����mol�� 0.4 0.2 0.4
ƽ������mol�� 0.4 0.2 0.2
SO2 ��ʾ�Ļ�ѧ��Ӧ����Ϊ
=0.05mol?L-1?min-1��
SO3��ת����Ϊ=
��100%��66.7%��
K=
=
=1.25��
�����������䣬��8minʱѹ�����������0.5L��ƽ��������Ӧ�����ƶ���n��SO3�����Ϊͼ��c��
�ʴ�Ϊ��0.05mol?L-1?min-1��66.7%��1.25�� c��
��3���õ�صı��ʷ�Ӧ�Ǻϳɰ���Ӧ�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ����������ӦʽΪN2+8H++6e-=2NH4+�����������ӣ����Ե������Һ��PH��������HCl��Ӧ�����Ȼ�泥���������ҺΪ�Ȼ����Һ��
�ʴ�Ϊ��N2+8H++6e-=2NH4+�������Ȼ�泥�
��2CO��g��+O2��g��=2CO2��g����H=-566.0kJ/mol
��H2O��g��=H2O��l����H=-44.0kJ/mol
��
| ��-��+�ۡ�4 |
| 2 |
��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ?mol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ?mol-1��
��2����a�������������䣬��ϵ���ܶȲ������仯������˵����Ӧ�ﵽƽ��״̬����a����
b�������������䣬SԪ���������䣬��ϵ����Ԫ�ص������ٷֺ������ٱ仯������˵����Ӧ�ﵽƽ��״̬����b����
c��SO2��SO3������ȱ��ֲ��䣬��˵����Ӧ�ﵽƽ��״̬����c��ȷ��
d �����ڵ���������������ٱ仯��˵�������ʵ�Ũ�Ȳ��䣬˵����Ӧ�ﵽƽ��״̬����d��ȷ��
e���κ�״̬�£���λʱ����ת��4mol ���ӣ�ͬʱ����2mol SO3������˵����Ӧ�ﵽƽ��״̬����e����
�ʴ�Ϊ��cd��
�����ݻ�Ϊ1L�ܱ������г���0.6molSO3����ͼ1ƽ��ʱSO3���ʵ���Ϊ0.2mol��
2SO2+O2?2SO3��
��ʼ����mol�� 0 0 0.6
�仯����mol�� 0.4 0.2 0.4
ƽ������mol�� 0.4 0.2 0.2
SO2 ��ʾ�Ļ�ѧ��Ӧ����Ϊ
| ||
| 8min |
SO3��ת����Ϊ=
| 0.4 |
| 0.6 |
K=
| c(SO 3) 2 |
| c(SO 2) 2c(O 2) |
| 0.2 2 |
| 0.4 2��0.2 |
�����������䣬��8minʱѹ�����������0.5L��ƽ��������Ӧ�����ƶ���n��SO3�����Ϊͼ��c��
�ʴ�Ϊ��0.05mol?L-1?min-1��66.7%��1.25�� c��
��3���õ�صı��ʷ�Ӧ�Ǻϳɰ���Ӧ�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ����������ӦʽΪN2+8H++6e-=2NH4+�����������ӣ����Ե������Һ��PH��������HCl��Ӧ�����Ȼ�泥���������ҺΪ�Ȼ����Һ��
�ʴ�Ϊ��N2+8H++6e-=2NH4+�������Ȼ�泥�
���������⿼���Ϊ�ۺϣ�Ϊ�߿��������ͣ������ڻ�ѧƽ����й�֪ʶ���绯ѧ���й�֪ʶ�Ŀ��飬ע����������Ի�ѧƽ���Ӱ���Լ��йػ�ѧ���㣬��������ۺ���ǿ���ѶȽϴ�

��ϰ��ϵ�д�
�����Ŀ
����Fe��FeO��Fe2O3��ɵĻ�����м���100mL2mol?L-1�����ᣬǡ��ʹ�������ȫ�ܽ⣬���ų�448mL���壨��״��������ʱ��Һ����Fe3+���ӣ��������ж���ȷ���ǣ�������
| A����������������ʷ�Ӧʱ������������ʵ���֮��Ϊ1��1��3 |
| B����Ӧ��������Һ�е�Fe2+������Cl-���ӵ����ʵ���֮��Ϊ1��2 |
| C��������FeO�����ʵ�����ȷ������Fe��Fe2O3�����ʵ����� |
| D��������Fe2O3�����ʵ�����ȷ������Fe��FeO�����ʵ����� |
���з�Ӧ��������Լ����ܱ���Ϊ����Һ���ǣ�������
| A������������Һ�еμӹ�����ˮ |
| B�����Ȼ�þ��Һ�еμӹ������ռ���Һ |
| C����ƫ��������Һ��ͨ�����CO2 |
| D�����Ȼ�����Һ��ͨ������Ķ�����̼ |
��һԪ���һԪ��������Һ���� pH�ֱ�Ϊ2��12������Һ�������Ϻ��pHΪ��������
| A��һ������7 |
| B��һ��С��7 |
| C��һ������7 |
| D�����ڣ�С�ڣ������7���п��� |