题目内容
12.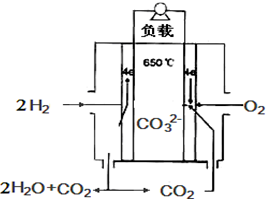 熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )
熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )| A. | 该电池放电时,负极的反应式为:H2-2e-+CO32-═H2O+CO2 | |
| B. | 该电池中CO32-的为由左边移向右边移动 | |
| C. | 该电池放电时,正极的反应式为:O2+2CO2+4e-═2CO32- | |
| D. | 该电池放电时,当转移4mol e-时正极消耗1mol O2和2mol CO2 |
分析 该燃料电池中,通入燃料氢气的电极是负极,通入氧化剂氧气的电极是正极,负极反应式为H2-2e-+CO32-=CO2+H2O,正极反应式为O2+2CO2+4e-═2CO32-,放电时,电解质中阴离子向负极移动,阳离子向正极移动,据此分析解答.
解答 解:该燃料电池中,通入燃料氢气的电极是负极,通入氧化剂氧气的电极是正极,负极反应式为H2-2e-+CO32-=CO2+H2O,正极反应式为O2+2CO2+4e-═2CO32-,
A.放电时负极反应式为H2-2e-+CO32-=CO2+H2O,故A正确;
B.放电时,电解质中阴离子向负极移动,阳离子向正极移动,所以碳酸根离子由右向左移动,故B错误;
C.该电池放电时,正极上氧气得电子和二氧化碳反应生成碳酸根离子,所以正极的反应式为:O2+2CO2+4e-═2CO32-,故C正确;
D.该电池放电时,根据O2+2CO2+4e-═2CO32-知,当转移4mol e-时,正极消耗1mol O2和2mol CO2,故D正确;
故选B.
点评 本题考查化学电源新型电池,为高频考点,明确原电池原理是解本题关键,难点是电极反应式的书写,常见燃料电池电解质有酸、碱、熔融碳酸盐、熔融氧化物类型,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.在一定条件下,8.8g CO2 与足量的Na2O2固体完全反应后,产生的气体全部收集起来只有1.68L(标准状况),则此气体在标准状况下的密度为( )
| A. | 1.43g/L | B. | 1.90g/L | C. | 2.14g/L | D. | 2.38g/L |
3.如图曲线A和B是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是( )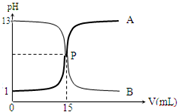

| A. | NaOH溶液的浓度为0.1 mol•L-1 | |
| B. | P点时可能未完全反应,溶液呈可能呈酸性也可能呈碱性 | |
| C. | 曲线A是盐酸滴定氢氧化钠溶液的测定曲线 | |
| D. | 本实验的指示剂不能用甲基橙,只能用酚酞 |
20.常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3•H2O溶液.下列说法正确的是( )
| A. | 同物质的量浓度的三种溶液的pH:a=b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a=b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
7.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 需要加热的反应说明它是吸热反应 |
1.2008北京奥运会圆满结束,其中“祥云”火炬燃料是丙烷(C3H8)气体.以丙烷、氧气和CO2及熔融碳酸盐可制作新型燃料电池,电池的总反应式为:C3H8+5O2═3CO2+4H2O.下列说法正确的是( )
| A. | 每消耗1 mol C3H8可以向外电路提供12 mol e- | |
| B. | 负极通入C3H8,发生还原反应 | |
| C. | 正极通入氧气和CO2,正极反应式是:O2+2CO2+4e-═2CO32- | |
| D. | CO32-移向电池的正极 |
2.下列各组离子中,能在溶液中大量共存的是( )
| A. | H+ Na+CO32- Cl- | B. | Mg2+ Na+Cl- SO42- | ||
| C. | K+ NH4+ SO42-OH- | D. | Fe2+ Al3+ NO3-H+ |