题目内容
11.X和Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是( )| A. | X的金属性比Y的金属性弱 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X元素的氢氧化物碱性小 | |
| D. | X元素的最高化合价比Y 元素的最高化合价低 |
分析 X和Y元素的原子在化学反应中都容易失去电子,则应为金属元素,形成与Ne原子具有相同电子层结构的离子,说明X和Y都位于周期表第三周期,且X的原子序数大于Y的原子序数,结合同周期元素的性质的递变规律解答该题.
解答 解:X和Y元素的原子在化学反应中都容易失去电子,则应为金属元素,形成与Ne原子具有相同电子层结构的离子,说明X和Y都位于周期表第三周期,且X的原子序数大于Y的原子序数,
A.同周期元素从左到右元素的金属性逐渐减弱,则有金属性Y>X,故A正确;
B.如Y为Na,可与水剧烈反应,故C错误;
C.金属性Y>X,元素的金属性越强,对应的最高价氧化物对应水化物的碱性越强,故C错误;
D.同周期元素从左到右元素的原子最外层电子数逐渐增多,金属元素的化合价逐渐增大,故D错误.
故选A.
点评 本题考查原子结构与元素周期律的关系,侧重于同周期元素的性质的递变规律,题目难度不大,注意把握元素周期律知识.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
2.下列离子方程式中,不正确的是( )
| A. | 氢氧化铜与硫酸反应:Cu(OH)2+2H+=Cu2++2H2O | |
| B. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氧化铜与硫酸反应:CuO+2H+=Cu2++H2O |
19.现有二氧化硅、石灰石、硅酸钠三种白色粉末,只用一种试剂就可以将它们鉴别开,该试剂是( )
| A. | 纯水 | B. | 碳酸钠溶液 | C. | 氯化钙溶液 | D. | 盐酸 |
6.下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
| A. | Ba(OH)2.8H2O与NH4Cl反应 | B. | 钠与冷水的反应 | ||
| C. | 灼热的炭与CO2反应 | D. | 甲烷与O2的燃烧反应 |
 向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7. .
.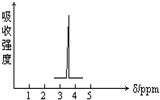 化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:BrCH2CH2Br,请预测B的核磁共振氢谱上有2个峰(信号),强度之比为3:1.
化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:BrCH2CH2Br,请预测B的核磁共振氢谱上有2个峰(信号),强度之比为3:1.