题目内容
16.写出下列反应的方程式(1)乙醇的催化氧化反应方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O
(2)乙醛与银氨溶液反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COONH4+2Ag+3NH3+H2O
(3)实验室制取乙烯的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2↑+H2O
(4)乙酸乙酯在酸性条件下的水解反应方程式
 .
.
分析 (1)乙醇催化氧化,生成乙醛和水;
(2)乙醛与银氨溶液反应生成醋酸铵、银单质、氨气和水;
(3)实验室用加热170℃乙醇和浓硫酸混合溶液制取乙烯;
(4)乙酸乙酯含有酯基,可发生水解反应生成乙酸、乙醇.
解答 (1)乙醇催化氧化,生成乙醛和水,反应方程式:2CH3CH2OH+O2 $→_{△}^{Cu}$ 2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$ 2CH3CHO+2H2O;
(2)乙醛与银氨溶液发生银镜反应,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH $\stackrel{水浴加热}{→}$ CH3COONH4+2Ag+3NH3+H2O;
故答案为:CH3CHO+2Ag(NH3)2OH $\stackrel{水浴加热}{→}$ CH3COONH4+2Ag+3NH3+H2O;
(3)乙醇在浓硫酸做催化剂、脱水剂条件下加热到170度生成乙烯和水,方程式:CH3CH2OH $→_{170℃}^{浓硫酸}$ H2C=CH2↑+H2O;
故答案为:CH3CH2OH $→_{170℃}^{浓硫酸}$ H2C=CH2↑+H2O;
(4)乙酸乙酯含有酯基,可发生水解反应生成乙酸、乙醇,方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的机构和性质,为高考常见题型,注意把握有机物的官能团的性质以及相关方程式的书写,为解答该题的关键,注意方程式中条件的标注.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.相同温度下,pH和体积均相同盐酸和醋酸两种溶液,它们的( )
| A. | 溶液中溶质的物质的量相等 | B. | 溶液中的c(H+)相等 | ||
| C. | 与足量锌粉反应产生的H2量相等 | D. | 可以电离出来的n(H+)相等 |
7.有关原电池的下列说法中不正确的是( )
| A. | 电池负极发生氧化反应 | |
| B. | 一般相对活泼的金属材料做电池的负极 | |
| C. | 电子流向是从负极流向正极(外电路) | |
| D. | 阳离子移向负极(内电路) |
4.下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Mg(OH)2>B(OH)2
③氧化性:F>Si>O
④还原性:HCl<H2S<SiH4.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Mg(OH)2>B(OH)2
③氧化性:F>Si>O
④还原性:HCl<H2S<SiH4.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
11.X和Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是( )
| A. | X的金属性比Y的金属性弱 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X元素的氢氧化物碱性小 | |
| D. | X元素的最高化合价比Y 元素的最高化合价低 |
1.DDT是人类合成得到的第一种有机农药,它的结构简式如图所示,有关它的说法正确的是( )
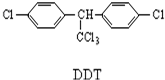

| A. | 它属于芳香烃 | B. | 分子式为C14H8Cl5 | ||
| C. | 1mol该物质能与6mol H2加成 | D. | 分子中最多可能有28个原子共面 |
8.下列各项与化学平衡移动原理无关的是( )
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 加压条件下有利于SO2和O2反应生成SO3 |
5.甲醇是一种重要的化工原料,广泛应用于化工生产,也可直接用作燃料.已知:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=-443.64kJ•mol-1;2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1.下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1453.28kJ•mol-1 | |
| D. | 完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ |
6.原子结构、元素周期律和元素周期表对于我们化学学习具有理论指导意义,下列有关说法正确的是( )
| A. | 同周期的主族元素从左到右原子半径逐渐减小,它们形成简单的离子半径逐渐增大 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟、氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |