题目内容
20.求算下列溶液中H2O电离出的c(H+)和c(OH-).(1)pH=3的H2SO4溶液 c(H+)=10-11mol•L-1,c(OH-)=10-11mol•L-1.
(2)pH=11的NaOH溶液 c(H+)=10-11mol•L-1,c(OH-)=10-11mol•L-1.
(3)pH=3的NH4Cl溶液 c(H+)=10-3mol•L-1.
(4)pH=11的Na2CO3溶液 c(OH-)=10-3mol•L-1.
分析 电解质溶液中常温下存在离子积常数,溶液中Kw=c(H+)c(OH-),酸溶液中Kw=c酸(H+)c水(OH-),碱溶液中Kw=c水(H+)c碱(OH-),强酸弱碱盐溶液中Kw=c水剩余(H+)c水(OH-),强碱弱酸盐溶液中Kw=c水(H+)c水剩余(OH-),
解答 解:(1)pH=3的H2SO4溶液中c酸(H+)=10-3mol/L,c水(OH-)=c水(H+)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=10-11mol/L,故答案为:10-11mol•L-1;10-11mol•L-1;
(2)碱溶液中Kw=c水(H+)c碱(OH-),pH=11的NaOH溶液中c水(H+)=c水(OH-)=10-11mol/L,
故答案为:10-11 mol•L-1;10-11 mol•L-1;
(3)强酸弱碱盐溶液中Kw=c水剩余(H+)c水(OH-),pH=3的NH4Cl溶液中c水(OH-)=c水(H+)=10-3 mol•L-1
故答案为:10-3 mol•L-1;
(4)强碱弱酸盐溶液中Kw=c水(H+)c水剩余(OH-),pH=11的Na2CO3溶液中,c水(OH-)=c水(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3 mol•L-1
故答案为:10-3mol•L-1 ;
点评 本题考查弱电解质的电离,侧重于水的电离的考查,注意把握影响水的电离的因素以及水的离子积常数的特点,离子积常数的计算应用是解题关键,题目难度中等.

练习册系列答案
相关题目
11.X和Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是( )
| A. | X的金属性比Y的金属性弱 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X元素的氢氧化物碱性小 | |
| D. | X元素的最高化合价比Y 元素的最高化合价低 |
8.下列各项与化学平衡移动原理无关的是( )
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 加压条件下有利于SO2和O2反应生成SO3 |
15.下列有关仪器的使用,正确的是( )
| A. | 用托盘天平称取21.82g食盐 | |
| B. | 用酸式滴定管量取15.30mL 0.10mol/L H2SO4溶液 | |
| C. | 用量筒量取13.56mL盐酸 | |
| D. | 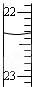 滴定达终点时,右图滴定管的正确读数为23.65mL |
5.甲醇是一种重要的化工原料,广泛应用于化工生产,也可直接用作燃料.已知:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=-443.64kJ•mol-1;2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1.下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1453.28kJ•mol-1 | |
| D. | 完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ |
9.根据表中有关短周期元素性质的数据判断,下列说法不正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 主要化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | 元素④和⑦的最高价氧化物的水化物的化学式不一定都为HRO3 | |
| B. | 元素③和⑥的最高价氧化物的水化物中,只有⑥的最高价氧化物的水化物能与Al(OH)3反应 | |
| C. | 元素①与元素②形成的化合物中不可能存在共价键 | |
| D. | 元素⑤的简单离子的半径是同周期主族元素简单离子中最大的 |
10.下列物质中,不属于醇类的是( )
| A. | C6H5CH2OH | B. | C6H5OH | C. | CH3OH | D. | CH3CH2OH |