题目内容
7.已知断裂1mol C-H,O=O,C=O,H-O化学键所需能量分别为a KJ,bKJ,cKJ,dKJ,则该反应CH4+O2=CO2+2H2O 的反应热为△H=2c+4d-(4a+b)kJ•mol-1.分析 根据反应焓变=反应物键能之和-生成物键能之和计算.
解答 解:由断裂1mol C-H,O=O,C=O,H-O化学键所需能量分别为a KJ,bKJ,cKJ,dKJ,则CH4+O2=CO2+2H2O的焓变=4a+b-(2c+4d),所以1mol CH4完全燃烧放出热量为2c+4d-(4a+b)KJ,反应CH4+O2=CO2+2H2O 的反应热为△H=[2c+4d-(4a+b)]KJ/mol,
故答案为:2c+4d-(4a+b).
点评 本题考查了焓变的计算应用,主要是反应焓变为反应物键能之和-生成物键能之和计算,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
19.工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
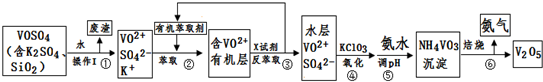
请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作I的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移提高了钒的萃取率.
③中X试剂为硫酸.
(3)④的离子方程式为NH3•H2O+VO3-═NH4VO3↓+OH-.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为1.7-1.8.
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.

请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作I的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移提高了钒的萃取率.
③中X试剂为硫酸.
(3)④的离子方程式为NH3•H2O+VO3-═NH4VO3↓+OH-.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.
15.对下列事实解释不正确的是( )
| 选项 | 事 实 | 解 释 |
| A | 金属镁燃烧不能用CO2来扑灭 | 镁与CO2要反应 |
| B | 一滴水中大约有1.67×1021个水分子 | 水分子很小 |
| C | 敞口容器中的酒精逐渐减少 | 分子是不断运动的 |
| D | 遭到核辐射后要多吃含“碘”食物 | 碘元素能屏蔽核辐射 |
| A. | A | B. | B | C. | C | D. | D |
2.在一个密闭容器中有N2和H2,在一定条件下反应.10min后测得NH3的浓度为2mol•L-1,则在这10min内NH3的平均反应速率是( )
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
12.合成导电高分子材料PPV的反应:
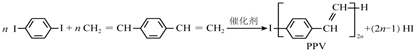
下列说法正确的是( )
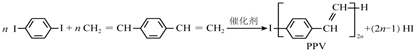
下列说法正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 1mol 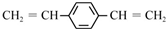 最多可以和5mol氢气发生加成反应 最多可以和5mol氢气发生加成反应 |
16.在常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,其中消耗氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C4H10 | D. | C3H8 |