题目内容
19.工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作I的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移提高了钒的萃取率.
③中X试剂为硫酸.
(3)④的离子方程式为NH3•H2O+VO3-═NH4VO3↓+OH-.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.
分析 将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程,水溶过滤得到含VO2+、SO42-、K+的溶液,加入有机萃取剂分液得到含VO2+的有机层,再经过反萃取得到水层,加入KClO3氧化VO2+为VO3-,加入氨水调节溶液PH形成NH4VO3沉淀,灼烧得到V2O5,
(1)废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅;
(2)②中萃取时必须加入适量碱,会和平衡中的氢离子反应促进平衡正向进行;③中反萃取时加入的X试剂是抑制平衡正向进行;
(3)依据氨水与VO3-反应配平得到离子方程式;
(4)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.8,此时钡沉淀率达到最大,需要氨水量较小;依据沉淀溶度积计算分析;
(5)分析流程图,物质参加反应,反应过程中又生成可以循环利用;
解答 解:(1)废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,V2O5、Fe2O3和酸反应,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅,
故答案为:SiO2;过滤;
(2)②中萃取时必须加入适量碱,分析平衡,Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行,
故答案为:加入碱中和产生的酸,平衡右移提高了钒的萃取率;硫酸;
(3)氨水与VO3-反应的离子方程式为:NH3•H2O+VO3-═NH4VO3↓+OH-,故答案为:NH3•H2O+VO3-═NH4VO3↓+OH-;
(4)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.7-1.8,此时钡沉淀率达到最大,需要氨水量较小;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,此时PH=2,c(H+)=10-2mol/L,c(OH-)=10-12mol/L,则溶液中c(Fe3+)浓度依据溶度积计算,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.6×10-39,计算得到c(Fe3+)=2.6×10-3mol•L-1,不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1,
故答案为:1.7-1.8;2.6×10-3;
(5)分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用,故答案为:有机萃取剂;氨气.
点评 本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等.

| A. | 加热氯化铵 | B. | 干冰气化 | C. | 水通电分解 | D. | 氯化氢溶于水 |
| A. | 16O→18O的转化属于化学变化 | |
| B. | 除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 | |
| C. | 冶金厂常用高压电除去烟尘,是因为胶体带电荷 | |
| D. | 少量Cu将足量浓、稀硝酸分别还原为NO2和NO,其转移电子数之比为1:3 |
①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511KJ/mol
下列说法正确的是( )
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101kPa 下,Na2O2(s)+2 Na(s)═2Na2O(s)△H=-317kJ/mol |

| A. | 该有机化合物含有3种官能团 | |
| B. | 该有机物分子中最多有12个碳原子在同一平面内 | |
| C. | 该有机物分子中最多有6个碳原子共线 | |
| D. | 该有机物分子中最多有14个碳原子在同一平面内 |
| A. | 促进双缩脲反应 | B. | 消除色素类对比色的干扰 | ||
| C. | 促进难溶性物质沉淀 | D. | 保持反应物颜色的稳定 |
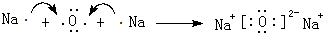 .
.
 ;
; .
.