题目内容
1.对于胃溃疡较重的病人,不适合使用的抑酸剂是( )| A. | Mg(OH)2 | B. | Al(OH)3 | C. | NaHCO3 | D. | MgCO3 |
分析 胃药的成分是能跟盐酸起反应的物质,以减少胃中盐酸的含量,反应生成物应无毒,由于是胃溃疡较重,不宜生成气体,否则会造成胃穿孔,加重病情.
解答 解:A.Mg(OH)2是不溶性的碱,能中和胃酸降低胃中的酸度,故A不选;
B.Al(OH)3是不溶性的碱,能中和胃酸降低胃中的酸度,故B不选;
C.NaHCO3是一种盐,水溶液呈微碱性,与盐酸反应生成二氧化碳气体,会造成胃穿孔,加重病情,故C选;
D.MgCO3与盐酸反应生成二氧化碳气体,会造成胃穿孔,加重病情,故D选.
故选CD.
点评 本题考查抗酸剂,题目难度不大,注意胃酸的主要成分中含有盐酸,注意掌握中和反应的原理是解题的关键,侧重于考查学生对化学知识的应用能力.

练习册系列答案
相关题目
11.无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3(s)+6Cl2(g)$\frac{\underline{\;高温\;}}{\;}$4AlCl3(g)+3O2(g)△H>0.下列分析错误的是( )
| A. | 增大反应体系的压强,反应速率增大 | |
| B. | 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 | |
| C. | 电解熔融的Al2O3和AlCl3均能得到单质铝 | |
| D. | 升高温度,反应的平衡常数将增大 |
12. 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
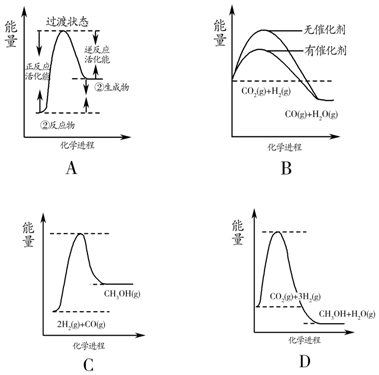
(5)根据表格测得焓变,下列能量关系图合理的是AD.
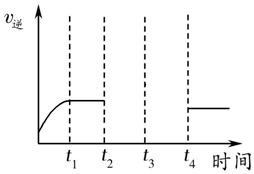
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是AD.

(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
6.下列离子方程式书写正确的是( )
| A. | 碳酸钙中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸钠溶液中加入氢氧化铜:Cu2++CO32-═CuCO3↓ | |
| D. | 澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
13.下列离子方程式正确的是( )
| A. | 稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氧化铜与稀硫酸反应:2H++O2-═H2O | |
| D. | 碳酸钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
10.下列现象或事实的解释正确的是( )
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | 光导纤维具有很强的导电能力,应用于制造通信光缆 | |
| C. | 过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水 | |
| D. | FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应 |

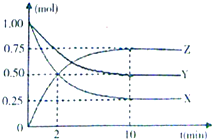 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.