题目内容
5.裂解水制氢气的过程如图所示.下列说法不正确的是( )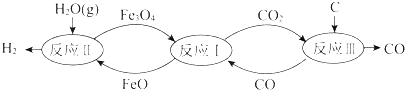
| A. | 反应Ⅰ的化学方程式是Fe3O4+CO?3FeO+CO2 | |
| B. | 反应Ⅱ的化学方程式是3FeO+H2O(g)?Fe3O4+H2 | |
| C. | 总反应的化学方程式是C+2H2O(g)?CO2+2H2 | |
| D. | 铁的氧化物是裂解水的催化剂 |
分析 A.根据图示信息可知,反应Ⅰ:反应物为Fe3O4、CO,生成物为FeO、CO2;
B.根据图示信息可知,反应Ⅱ:反应物为FeO、H2O,生成物为Fe3O4、H2;
C.反应Ⅲ:反应物为CO2、C,生成物为CO;裂解水制氢气,将反应Ⅰ+Ⅱ+Ⅲ得总反应;
D.在化学反应里能改变其他物质的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质叫做催化剂.
解答 解:A.反应Ⅰ:反应物为Fe3O4、CO,生成物为FeO、CO2,反应为:Fe3O4+CO?3FeO+CO2,故A正确;
B.反应Ⅱ:反应物为FeO、H2O,生成物为Fe3O4、H2,反应为:3FeO+H2O(g)?Fe3O4+H2,故B正确;
C.反应Ⅲ:反应物为CO2、C,生成物为CO,反应为:C+CO2=2CO,将反应Ⅰ+Ⅱ+Ⅲ得总反应为C+,H2O(g)?CO+H2,故C错误;
D.铁的氧化物四氧化三铁参与反应,但总反应为C+,H2O(g)?CO+H2,反应产物没有四氧化三铁,所以铁的氧化物是裂解水的催化剂,故D正确;
故选C.
点评 本题考查方程式的书写,注意利用题干信息、根据催化剂的特点分析是解答关键,题目难度不大

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
14.置于空气中的下列物质,因被氧化而呈现黄色的是( )
| A. | 浓硝酸 | B. | 氯化亚铁溶液 | C. | 工业盐酸 | D. | 溴化银 |
16. 电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
 电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )| A. | ①点溶液中c (H+)为0.200 mol•L-l | |
| B. | 若反应容器与外界没有热交换,反应后溶液温度高低为①>③>② | |
| C. | pH的大小为:③>②>①,且③点溶液中有c(Cl-)>c(CH3COO-) | |
| D. | ③点后因离子数目减少使溶液电导率略降低 |
20.下列有关性质比较正确的是( )
| A. | N、O、F最高正价依次升高 | |
| B. | Al3+、Na+、O2-微粒半径依次增大 | |
| C. | F2、Cl2、Br2、I2单质的熔点逐渐降低 | |
| D. | 锂、钠、钾、铷单质与水反应置换出氢气越来越难 |
10.乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂不正确的是( )
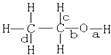

| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和浓硫酸共热至170℃时键b和d断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和氢溴酸反应键a断裂 |
17.将NaCl、AlCl3、FeCl3、NH4Cl四种溶液区分开,只用一种试剂,该试剂是( )
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
14.下列化合物同分异构体最多的是( )
| A. | 丁烷 | B. | 丙酸甲酯 | C. | 丁烯 | D. | 二氯丁烷 |
15.有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液.若将甲蒸发掉一半水,在乙中通入少量CO2,丙不变.然后用同浓度H2SO4溶液滴定,完全反应生成Na2SO4,所需H2SO4溶液的体积是( )
| A. | 甲=丙>乙 | B. | 丙>乙>甲 | C. | 乙>丙>甲 | D. | 甲=乙=丙 |
 在2L的密闭容器中,高温下发生下列反应:
在2L的密闭容器中,高温下发生下列反应: