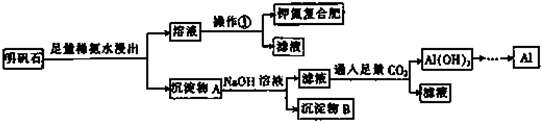
题目内容
14.下列化合物同分异构体最多的是( )| A. | 丁烷 | B. | 丙酸甲酯 | C. | 丁烯 | D. | 二氯丁烷 |
分析 A.烷烃只有碳链异构;
B.丙酸甲酯存在官能团异构、位置异构、碳链异构等同分异构体;
C.烯烃存在官能团位置异构、与环烷烃互为同分异构体;
D.氯代烃存在的是官能团的位置异构,两个氯可以连在同一个碳上.
解答 解:A.丁烷的同分异构体有CH3CH2CH2CH3、(CH3)2CHCH3共2种;
B.丙酸甲酯的分子式为C4H8O2,其同分异构体有:羧酸:CH3CH2CH2COOH、CH3CH(CH3)COOH;酯:HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3;醇:HOCH2CH=CHCH2OH、CH2=CHCH(OH)CH2OH、CH2=C(CH2OH)2;酮:HOCH2COCH2CH3、CH3COCH(OH)CH3、CH3COCH2CH2OH;醛:CH3CH2CH(OH)CHO、CH3CH(OH)CH2CHO、HOCH2CH2CH2CHO除了链状的还有环状的,共应大于14种;
C.丁烯CH2=CHCH2CH3的同分异构体为CH3CH=CHCH3、CH2=C(CH3)2、甲基环丙烷,共3种;
D.先分析丁烷一氯代物,正丁烷共有2种一氯代物,然后以一氯代物为基础再添上一个氯,可得二氯代物,正丁烷的二氯代物共有6种,即
CH3CH2CH2CHCl2、CH3CH2CHClCH2Cl、CH3CHClCH2CH2Cl、CH2ClCH2CH2CH2Cl,CH3CCl2CH2CH3,CH3CHClCHClCH3;
异丁烷的一氯代物有2种:(CH3)2CHCH2Cl、(CH3)2CClCH3,然后以一氯代物为基础再添上一个氯,可得二氯代物异丁烷二氯代物有3种:
(CH3)2CHCHCl2、(CH3)2CClCH2Cl、CH3CH(CH2Cl)2,所以丁烷的二氯代物共有9种;
故选B.
点评 本题考查同分异构体的种类,根据官能团异构和位置异构和碳链异构来综合分析同分异构体的种数,难度较大,但要注意按照一定的顺序书写同分异构体.

 阅读快车系列答案
阅读快车系列答案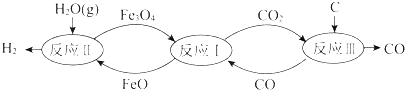
| A. | 反应Ⅰ的化学方程式是Fe3O4+CO?3FeO+CO2 | |
| B. | 反应Ⅱ的化学方程式是3FeO+H2O(g)?Fe3O4+H2 | |
| C. | 总反应的化学方程式是C+2H2O(g)?CO2+2H2 | |
| D. | 铁的氧化物是裂解水的催化剂 |
| A. | 在反应2 H2S+SO2→3 S+2 H2O中被氧化与被还原的硫原子的质量 | |
| B. | 相同温度下,0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 CH3COOH溶液中的c(H+) | |
| C. | 在密闭容器中,N2+3H2?2NH3达平衡时的c(NH3)与c(N2) | |
| D. | Na2CO3晶体中Na+与CO32-离子个数比 |
| A. | 1.5g CH3+含有的电子数为NA | |
| B. | 在lL 0.lmol/L氯化铝溶液中阳离子总数大于0.lNA | |
| C. | 标准状况下,11.2L四氯化碳中含有的C-CI键的个数为2NA | |
| D. | 60g SiO2和12g金刚石中各含有4NA个Si-O键和4NA个C-C键 |
 水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:
水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:| 相对分子 质量 | 沸点/℃: | 在水中的溶解性 | |
| 甲醇 | 32 | 64.7 | 与水以任何比例相溶 |
| 水杨酸 | 138 | 211 | 0.22g/100ml |
| 水杨酸甲酯 | 152 | 222 | 0.07g/100ml |
 +CH3OH$\stackrel{H+}{?}$
+CH3OH$\stackrel{H+}{?}$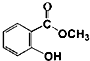 +H2O
+H2O实验步骤:
①在干燥的三颈烧瓶中入7.0g水杨酸、30mL(0.64moL)甲醇、3mL浓H2SO4和2~3片碎瓷片,在85~95℃下加热回流(如图甲);
②1.5h后将回流装置改为蒸馏装置,水浴加热(如图乙);
③余下的反应液冷却至室温,依次用水、碳酸钠溶液和水洗涤,后再分离(如图丙);
④分出的产物加入少量无水CaCl2固体,静置片刻后过滤,
⑤对滤液蒸馏纯化,收集221~224℃馏分,得水杨酸甲酯6.1g.
⑥其它量不变,改用2mL浓H2SO4重复上述操作,得水杨酸甲酯5.5g.
回答下列问题:
(1)甲中所用三颈烧瓶应选用A
A.100mL B.150mL C.250mL D.500mL
(2)整个实验两次用到蒸馏装置,第一次用蒸馏装置的目的是:甲醇有毒,用于回收甲醇.
(3)步骤③中所用到的玻璃仪器的名称是分液漏斗、锥形瓶;
(4)本实验甲醇要过量,其目的是提高水杨酸的转化率,
(5)步骤③要进行两次水洗,如果没有进行第二次水洗,可能的后果是残留的碳酸钠与CaCl2反应生成沉淀堵塞分液漏斗,并在蒸馏时会促进水杨酸甲酯的水解.
(6)浓H2SO4的用量为3mL时,水杨酸甲酯的产率是79.2%,
(7)该实验中,浓硫酸主要表现了催化、吸水性质.
| A. | 用乙烯合成聚乙烯 | |
| B. | 分馏石油得到汽油、柴油、重油等产物 | |
| C. | 铝铁在冷、浓硫酸中钝化 | |
| D. | 食物腐败变酸 |
| A. |  若采用图示装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| B. |  向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量 | |
| C. |  达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 | |
| D. |  将pH=2的盐酸和醋酸分别加水稀释,a点溶液中水的电离程度比b点溶液中水的电离程度大 |
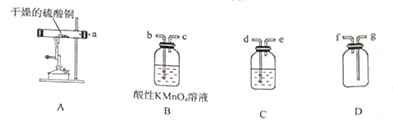 CuSO4•5H2O是铜的重要化合物,有着广泛的应用.硫酸铜在高温下分解可得到SO2、SO3、O2和Cu2O.
CuSO4•5H2O是铜的重要化合物,有着广泛的应用.硫酸铜在高温下分解可得到SO2、SO3、O2和Cu2O.