题目内容
20.下列有关性质比较正确的是( )| A. | N、O、F最高正价依次升高 | |
| B. | Al3+、Na+、O2-微粒半径依次增大 | |
| C. | F2、Cl2、Br2、I2单质的熔点逐渐降低 | |
| D. | 锂、钠、钾、铷单质与水反应置换出氢气越来越难 |
分析 A.O、F无正价;
B.具有相同电子层结构的离子中,原子序数大的离子半径小;
C.卤素单质的相对分子质量越大,熔沸点越大;
D.金属性越强,与水反应越容易.
解答 解:A.N、O、F中只有N元素有最高正价,故A错误;
B.具有相同电子层结构的离子中,原子序数大的离子半径小,则Al3+、Na+、O2-微粒半径依次增大,故B正确;
C.卤素单质的相对分子质量越大,熔沸点越大,则F2、Cl2、Br2、I2单质的熔点逐渐增大,故C错误;
D.金属性越强,与水反应越容易,则锂、钠、钾、铷单质与水反应置换出氢气越来越易,故D错误;
故选B.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列实验中,反应速率加快是由催化剂引起的是( )
| A. | 把煤块变成煤粉燃烧更为剧烈 | |
| B. | 锌与稀硫酸反应制H2时加入少量CuSO4溶液而使反应速率加快 | |
| C. | 固态FeCl3和固态NaOH混合后,加入水能迅速产生沉淀 | |
| D. | 双氧水中加入少量MnO2,即可迅速放出气体 |
11.小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快.该小组通过实验探究其原因.请你和探究小组完成下列问题:
(1)提出合理假设.该实验中反应速率明显加快的原因可能是AC.
A.反应放热导致温度升高 B.压强增大
C.生成物的催化作用 D.反应物接触面积增大
(2)初步探究测定实验过程中不同时间溶液的温度,结果如表:
根据表中实验数据规律,结合实验假设你能得出的结论是温度不是反应速率明显加快的主要原因.
(3)进一步探究.查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用.为此,请你完成以下实验设计(将表格和实验目的补充完整):
表中X的值为,实验①和②探究Cu2+对实验的影响.
(1)提出合理假设.该实验中反应速率明显加快的原因可能是AC.
A.反应放热导致温度升高 B.压强增大
C.生成物的催化作用 D.反应物接触面积增大
(2)初步探究测定实验过程中不同时间溶液的温度,结果如表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
(3)进一步探究.查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用.为此,请你完成以下实验设计(将表格和实验目的补充完整):
| 实验 编号 | 铜片 质量/g | 0.1mol•L-1 硝酸/mL | 硝酸铜 溶液/mL | 亚硝酸钠 溶液/mL | 水的体积 /mL | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 0.5 | 实验①和②探究Cu2+对实验的影响;实验①和③探究亚硝酸根的影响. |
| ② | 5 | 20 | 0.5 | 0 | 0 | |
| ③ | 5 | 20 | 0 | X | 0 |
8.下列比较中,正确的是( )
| A. | 常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 | |
| B. | 0.2 mol/LNH4NO3 和 0.l mol/L NaOH 溶液等体积混合后:c(NH4+)>c (NO3-)>c (Na+)>c (OH-)>c (H+) | |
| C. | 物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c (Na+)+c(H+)=c (CH3COO-)+c (OH-)+c (CH3COOH) | |
| D. | 同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+) 由大到小的顺序是:①>②>④>③ |
15.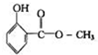 冬青油结构如图,它在一定条件下能发生的反应有:( )
冬青油结构如图,它在一定条件下能发生的反应有:( )
①加成反应
②水解反应
③消去反应
④取代反应
⑤与NaHCO3反应放出CO2
⑥加聚反应.
 冬青油结构如图,它在一定条件下能发生的反应有:( )
冬青油结构如图,它在一定条件下能发生的反应有:( )①加成反应
②水解反应
③消去反应
④取代反应
⑤与NaHCO3反应放出CO2
⑥加聚反应.
| A. | ①②⑥ | B. | ①②③ | C. | ④⑤⑥ | D. | ①②④ |
5.裂解水制氢气的过程如图所示.下列说法不正确的是( )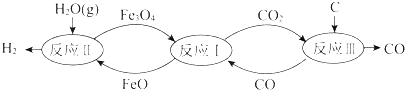

| A. | 反应Ⅰ的化学方程式是Fe3O4+CO?3FeO+CO2 | |
| B. | 反应Ⅱ的化学方程式是3FeO+H2O(g)?Fe3O4+H2 | |
| C. | 总反应的化学方程式是C+2H2O(g)?CO2+2H2 | |
| D. | 铁的氧化物是裂解水的催化剂 |
9.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1.5g CH3+含有的电子数为NA | |
| B. | 在lL 0.lmol/L氯化铝溶液中阳离子总数大于0.lNA | |
| C. | 标准状况下,11.2L四氯化碳中含有的C-CI键的个数为2NA | |
| D. | 60g SiO2和12g金刚石中各含有4NA个Si-O键和4NA个C-C键 |
10.常温时向0.01mol/L 的盐酸溶液中加入等体积的下列溶液,滴入酚酞试液显红色,该溶液是( )
| A. | pH=12的Ba(OH)2溶液 | B. | pH=12的氨水 | ||
| C. | 0.01mol/L AgNO3溶液 | D. | 0.005mol/L NaOH溶液 |