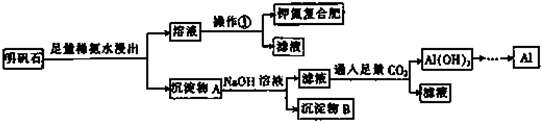
题目内容
15.有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液.若将甲蒸发掉一半水,在乙中通入少量CO2,丙不变.然后用同浓度H2SO4溶液滴定,完全反应生成Na2SO4,所需H2SO4溶液的体积是( )| A. | 甲=丙>乙 | B. | 丙>乙>甲 | C. | 乙>丙>甲 | D. | 甲=乙=丙 |
分析 甲蒸发掉一半水,在乙中通入少量的CO2,丙不变,然后用同浓度H2SO4溶液滴定,完全反应生成Na2SO4,结合原子守恒计算所需H2SO4溶液的体积.
解答 解:甲蒸发掉一半水,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的硫酸,完全反应后溶液中的溶质均为Na2SO4,
等体积等物质的量浓度的NaOH溶液中n(NaOH)相同,
由原子守恒可知:2n(NaOH)~2n(H+)~n(H2SO4),
所以三者消耗硫酸的物质的量相同,由于硫酸的浓度相同,根据V=$\frac{n}{c}$可知消耗硫酸的体积相同,即甲=乙=丙,
故选D.
点评 本题考查物质的量浓度的计算,为高频考点,题目难度不大,侧重分析能力及计算能力的考查,把握反应后溶液中的溶质及原子守恒为解答的关键,利用守恒法可快速得到答案,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
5.裂解水制氢气的过程如图所示.下列说法不正确的是( )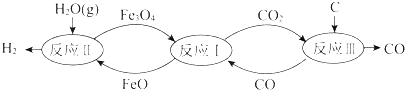

| A. | 反应Ⅰ的化学方程式是Fe3O4+CO?3FeO+CO2 | |
| B. | 反应Ⅱ的化学方程式是3FeO+H2O(g)?Fe3O4+H2 | |
| C. | 总反应的化学方程式是C+2H2O(g)?CO2+2H2 | |
| D. | 铁的氧化物是裂解水的催化剂 |
3.下列变化属于物理变化的是( )
| A. | 用乙烯合成聚乙烯 | |
| B. | 分馏石油得到汽油、柴油、重油等产物 | |
| C. | 铝铁在冷、浓硫酸中钝化 | |
| D. | 食物腐败变酸 |
10.常温时向0.01mol/L 的盐酸溶液中加入等体积的下列溶液,滴入酚酞试液显红色,该溶液是( )
| A. | pH=12的Ba(OH)2溶液 | B. | pH=12的氨水 | ||
| C. | 0.01mol/L AgNO3溶液 | D. | 0.005mol/L NaOH溶液 |
20.如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数是电子层数的2倍.下列说法不正确的是( )
| X | Y | ||
| Z | W |
| A. | W 的最高价氧化物的水化物酸性比Z的强 | |
| B. | 原子半径:Z>W,离子半径:Z<W | |
| C. | Y的气态氢化物可与W的气态氢化物反应生成一种离子化合物 | |
| D. | X元素形成的化合物种类最多 |
7.下列化学用语书写正确的是( )
| A. | 明矾的化学式为:KAl(SO4)2 | |
| B. | 氯离子的结构示意图为: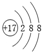 | |
| C. | 纯碱的化学式:NaCO3 | |
| D. | 氨水的电离方程式:NH3•H2O→NH4++H2O |
4.下列实验与对应的图象符合的是( )
| A. |  若采用图示装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| B. |  向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量 | |
| C. |  达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 | |
| D. |  将pH=2的盐酸和醋酸分别加水稀释,a点溶液中水的电离程度比b点溶液中水的电离程度大 |
5.下列说法不正确的是( )
| A. | 推广使用氢能、太阳能,减少化石燃料的使用,有助于减少雾霾天气的发生 | |
| B. | 将太阳能转化为氢能是减少污染、缓解能源危机的一种构想 | |
| C. | 石油的分馏、催化裂化、裂解等石油的加工方法,其目的均为得到更多的汽油 | |
| D. | 煤干馏可以得到煤焦油,煤焦油进一步分离又可得到苯、甲苯等有机物 |