题目内容
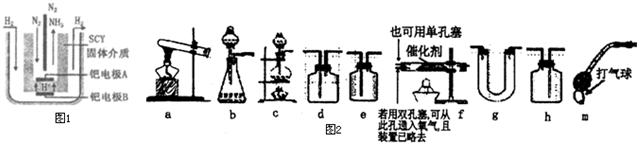
甲烷是天然气、沼气、坑气及煤气的主要成分,可用作燃料及制造氢气、一氧化碳、甲醛等物质的原料,其中用作制氢气合成氨的工艺流程示意图如下:

依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是 .
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2 mol,假设后面几步转化各物质均完全反应,则理论上可制备得到 氨气mol(用含n的代数式表示).
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是 .
A.相似相容原理 B.勒夏特列原理 C.酸碱中和原理
(4)分析流程示意图回答,该合成氨工艺主要起始原料是 ,辅助原料有 .
(5)整个流程有三处循环,一是Fe(OH)3循环,二是 循环,三是N2、H2循环.

依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是
A.相似相容原理 B.勒夏特列原理 C.酸碱中和原理
(4)分析流程示意图回答,该合成氨工艺主要起始原料是
(5)整个流程有三处循环,一是Fe(OH)3循环,二是
考点:工业合成氨,合成氨条件的选择
专题:氮族元素
分析:(1)硫化氢是酸性气体,可以和碱发生中和反应生成盐和水;
(2)计算出甲烷的物质的量,根据方程式计算氢气、氨气的物质的量;
(3)根据化学平衡移动原理加压有利于平衡向着气体系数和减小的方向进行来回答;
(4)利用氢气合成氨的工艺流程知道:起始原料是CH4、H2O、空气,而辅助原料是K2CO3、Fe(OH)3;
(5)根据合成氨的原理可以推知循环使用的是氮气和氢气,根据流程图确定其他循环使用的物质.
(2)计算出甲烷的物质的量,根据方程式计算氢气、氨气的物质的量;
(3)根据化学平衡移动原理加压有利于平衡向着气体系数和减小的方向进行来回答;
(4)利用氢气合成氨的工艺流程知道:起始原料是CH4、H2O、空气,而辅助原料是K2CO3、Fe(OH)3;
(5)根据合成氨的原理可以推知循环使用的是氮气和氢气,根据流程图确定其他循环使用的物质.
解答:
(1)流程图中已给出反应物是H2S和Fe(OH)3,生成物是Fe2S3和H2O,CH4没有参与反应,所以天然气脱硫时的化学方程式为3H2S+2Fe(OH)3═Fe2S3+6H2O,
故答案为:3H2S+2Fe(OH)3═Fe2S3+6H2O;
(2)根据方程式CH4+H2O→CO+3H2可知,生成CO0.9nmol,则生成氢气3×0.9nmol=2.7nmol.二次转化后,CH4全部转化为CO,即工生成nmolCO,和水蒸气反应:CO+H2O→CO2+H2,又产生nmol氢气,因此总共生成3.7nmol氢气,所以若后面几步转化各物质均完全反应,则理论上可制备得到氨气3.7nmol×2×
≈2.5nmol.
故答案为:2.7n,2.5n;
(3)CO2为气体,与K2CO3(aq)反应体积减小,所以加压有利于平衡右移,依据是勒夏特列原理,故选B;
(4)根据流程示意图可知,该合成氨工艺主要起始原料是CH4、H2O、空气,而辅助原料是K2CO3、Fe(OH)3,故答案为:CH4、H2O、空气;K2CO3;Fe(OH)3;
(5)合根据流程示意图可知,循环利用的物质除了氢氧化铁、氮气和氢气外,还有碳酸钾,故答案为:K2CO3(aq).
故答案为:3H2S+2Fe(OH)3═Fe2S3+6H2O;
(2)根据方程式CH4+H2O→CO+3H2可知,生成CO0.9nmol,则生成氢气3×0.9nmol=2.7nmol.二次转化后,CH4全部转化为CO,即工生成nmolCO,和水蒸气反应:CO+H2O→CO2+H2,又产生nmol氢气,因此总共生成3.7nmol氢气,所以若后面几步转化各物质均完全反应,则理论上可制备得到氨气3.7nmol×2×
| 1 |
| 3 |
故答案为:2.7n,2.5n;
(3)CO2为气体,与K2CO3(aq)反应体积减小,所以加压有利于平衡右移,依据是勒夏特列原理,故选B;
(4)根据流程示意图可知,该合成氨工艺主要起始原料是CH4、H2O、空气,而辅助原料是K2CO3、Fe(OH)3,故答案为:CH4、H2O、空气;K2CO3;Fe(OH)3;
(5)合根据流程示意图可知,循环利用的物质除了氢氧化铁、氮气和氢气外,还有碳酸钾,故答案为:K2CO3(aq).
点评:本题考查了天然气合成氨的有关知识,重点掌握相关物质的化学性质,考查了分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
下列分子中所有原子都满足最外层为8电子结构的是( )
| A、CCl4 |
| B、NO2 |
| C、PCl5 |
| D、NH3 |
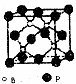 硼是新型无机材料中的明星元素.
硼是新型无机材料中的明星元素.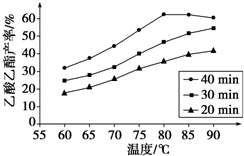 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯: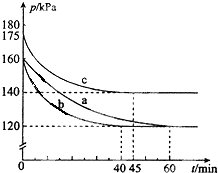 化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题:
化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题: