题目内容
合成氨反应在解决世界70亿人口的吃饭问题上起了重要的作用,合成氨的方法有很多.
(一)方法1:合成塔中发生反应N2+3H2(g)?2NH3(g),下表给出了500℃条件下,某恒容密闭容器中该反应起始和平衡时各物质的浓度数据,则平衡时N2的转化率为 ,该条件下反应的平衡数为 .
方法2:1998年2位希腊化学家提出了电解合成氨的新思路,采用高质子导电性的SCY陶瓷(能传递H+)
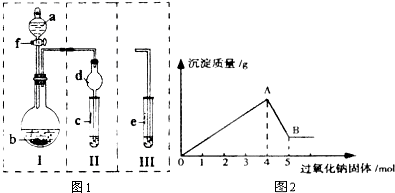
为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,装置如图1.钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 .
方法3:最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)
表面与水发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=a kJ/mol
进一步研究NH3生成量与温度的关系(其它条件均一样),反应3 小时,测得部分实验
数据如下表:
(1)依据上述数据,能否判断该反应是放热还是吸热反应?说出你的判断依据: .
(2)已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ?mol-1
求上述固氮反应的△H=
(二)NH3的另外一个重要用途是制备HNO3,提供如图2仪器(图中铁夹、橡皮管等辅助用品已略去,多余的仪器可以不用,个别仪器可以重复使用),请你组装出一套装置,模拟工业上氨的催化氧化,并保证在仪器e中能看到红棕色气体,最终能制得HNO3.请你写出所设计方案的仪器连接循序:a→ (将所连接仪器的顺序依次填入即可).若a仪器用m d代替,则d中装入得药品为 .若a仪器用b代替,则b中用到的药品为 .

(一)方法1:合成塔中发生反应N2+3H2(g)?2NH3(g),下表给出了500℃条件下,某恒容密闭容器中该反应起始和平衡时各物质的浓度数据,则平衡时N2的转化率为
| 初始浓度(mol/L) | 平衡浓度(mol/L) | ||||
| c0(N2) | c0(H2) | c0(NH3) | c平(N2) | c平(H2) | c平(NH3) |
| 2.48 | 4.34 | 0 | 1.85 | 2.43 | 1.27 |
为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,装置如图1.钯电极A是电解池的
方法3:最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)
表面与水发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=a kJ/mol
进一步研究NH3生成量与温度的关系(其它条件均一样),反应3 小时,测得部分实验
数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.8 | 6.0 |
(2)已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ?mol-1
求上述固氮反应的△H=
(二)NH3的另外一个重要用途是制备HNO3,提供如图2仪器(图中铁夹、橡皮管等辅助用品已略去,多余的仪器可以不用,个别仪器可以重复使用),请你组装出一套装置,模拟工业上氨的催化氧化,并保证在仪器e中能看到红棕色气体,最终能制得HNO3.请你写出所设计方案的仪器连接循序:a→
考点:工业合成氨,用盖斯定律进行有关反应热的计算,化学平衡的计算,电解原理,制备实验方案的设计
专题:基本概念与基本理论
分析:(一)方法1:利用三行式结合转化率=
×100%、K=
来计算;
方法2:电解池中,阳离子移向阴极,在阴极上发生还原反应;
方法3::(1)达到平衡时,可以根据温度对化学平衡移动方向的影响来判断反应的吸放热情况;
(2)根据盖斯定律计算焓变;
(二)氨的催化氧化中的氧气可以用空气代替,加热氯化铵和氢氧化钙的混合物可以制氨气,还可以用浓氨水和碱石灰(或生石灰、或是氢氧化钠固体)来制备,据此确定实验组装顺序以及试剂.
| 变化量 |
| 初始量 |
| 生成物平衡浓度系数次幂之积 |
| 反应物平衡浓度系数次幂之积 |
方法2:电解池中,阳离子移向阴极,在阴极上发生还原反应;
方法3::(1)达到平衡时,可以根据温度对化学平衡移动方向的影响来判断反应的吸放热情况;
(2)根据盖斯定律计算焓变;
(二)氨的催化氧化中的氧气可以用空气代替,加热氯化铵和氢氧化钙的混合物可以制氨气,还可以用浓氨水和碱石灰(或生石灰、或是氢氧化钠固体)来制备,据此确定实验组装顺序以及试剂.
解答:
解:(一)方法1:设平衡时N2的变化量是x,则
N2(g)+3H2(g)=2NH3(g)
初始浓度:2.48 4.34 0
变化浓度:0.63 1.91 1.27
平衡浓度:1.85 2.43 1.27
衡时N2的转化率为
×100%=25.4%,K=
=
=0.0608,故答案为:25.4%;0.0608;
方法2、电解池中,氢离子移向阴极,所以钯电极A是电解池的阴极,阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,即N2+6e-+6H+=2NH3,
故答案为:阴;N2+6H++6e-=2NH3;
方法3:(1)温度对化学平衡移动方向的影响是:温度越高,氨气的量越大,但是没有告诉说是进行到3小时达到了平衡,故无法判断反应的吸放热情况,
故答案为:不能;因为没有给出反应进行3小时是否达到了平衡;
②已知:a、N2(g)+3H2(g)=2NH3(g);△H=-92.4kJ/mol;
b、O2(g)+2H2(g)═2H2O(l);△H=-571.6kJ/mol,则反应2N2(g)+6H2O(l)═4NH3(g)+3O2(g)等于2a-3b;
所以△H=2×(-92.4kJ/mol)-3×(-571.6kJ/mol)=+1530.0kJ/mol,
故答案为:+1530.0kJ/mol;
(二)氨的催化氧化中的氨气可以用a制备,将氨气干燥,再和空气混合在催化剂的作用下可以获得NO,和空气相遇即可得到二氧化氮,二氧化氮和水反应,即可制的硝酸溶液,所以连接顺序是a→g→f→d→e→d,加热氯化铵和氢氧化钙的混合物可以制氨气,还可以用浓氨水和碱石灰(或生石灰、或是氢氧化钠固体)来制备,若a仪器用m d代替,则d中装入得药品为浓氨水,若a仪器用b代替,则b中用到的药品为浓氨水和生石灰(碱石灰或是氢氧化钠固体),用来制取氨气,
故答案为:a→g→f→d→e→d;浓氨水;浓氨水和生石灰(碱石灰或是氢氧化钠固体).
N2(g)+3H2(g)=2NH3(g)
初始浓度:2.48 4.34 0
变化浓度:0.63 1.91 1.27
平衡浓度:1.85 2.43 1.27
衡时N2的转化率为
| 0.63 |
| 2.48 |
| c2(NH3) |
| c(N2)?c3(H2) |
| 1.272 |
| 1.85×2.433 |
方法2、电解池中,氢离子移向阴极,所以钯电极A是电解池的阴极,阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,即N2+6e-+6H+=2NH3,
故答案为:阴;N2+6H++6e-=2NH3;
方法3:(1)温度对化学平衡移动方向的影响是:温度越高,氨气的量越大,但是没有告诉说是进行到3小时达到了平衡,故无法判断反应的吸放热情况,
故答案为:不能;因为没有给出反应进行3小时是否达到了平衡;
②已知:a、N2(g)+3H2(g)=2NH3(g);△H=-92.4kJ/mol;
b、O2(g)+2H2(g)═2H2O(l);△H=-571.6kJ/mol,则反应2N2(g)+6H2O(l)═4NH3(g)+3O2(g)等于2a-3b;
所以△H=2×(-92.4kJ/mol)-3×(-571.6kJ/mol)=+1530.0kJ/mol,
故答案为:+1530.0kJ/mol;
(二)氨的催化氧化中的氨气可以用a制备,将氨气干燥,再和空气混合在催化剂的作用下可以获得NO,和空气相遇即可得到二氧化氮,二氧化氮和水反应,即可制的硝酸溶液,所以连接顺序是a→g→f→d→e→d,加热氯化铵和氢氧化钙的混合物可以制氨气,还可以用浓氨水和碱石灰(或生石灰、或是氢氧化钠固体)来制备,若a仪器用m d代替,则d中装入得药品为浓氨水,若a仪器用b代替,则b中用到的药品为浓氨水和生石灰(碱石灰或是氢氧化钠固体),用来制取氨气,
故答案为:a→g→f→d→e→d;浓氨水;浓氨水和生石灰(碱石灰或是氢氧化钠固体).
点评:本题以考查工业合成氨为载体,涉及盖斯定律的应用、化学平衡转化率和平衡常数的计算以及电化学等综合知识,属于综合知识的考查,难度大.

练习册系列答案
相关题目
中学化学课本中有大量的数据资料.下面是某学生对数据的利用.其中不正确的是( )
| A、利用相对分子质量大小可以判断某些物质的熔沸点高低 |
| B、利用密度数据可判断液体物质挥发性的大小 |
| C、利用原子(或离子)半径数据可推断某些原子(或离子)的氧化性和还原性的强弱 |
| D、利用溶解度数据可推测将一些物质混合物分离开来的可能性 |
下列物质的颜色是白色的是( )
| A、Cu2O |
| B、CuO |
| C、CuSO4 |
| D、Na2O2 |
下列说法正确的是( )
| A、在由水电离产生的氢离子浓度为10-13mol?L-1的溶液中,Ca2+、K4、Cl-、HCO3-四种离子能大量共存 |
| B、已知MgCO3的Ksp=6.82x10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 |
| C、对于反应N2H4(l)=N2(g)+2H2(g);△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| D、常温下,将0.2mol?L-1某一元碱(ROH)溶液和0.1mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |