题目内容
 化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题:
化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题:(1)已知PCl3的熔点和沸点分别为-93.6℃和76.1℃,PCl5的熔点为167℃.室温时2molPCl3与气体Cl2完全反应生成PCl5,放出热量257.6kJ.该反应的热化学方程式为
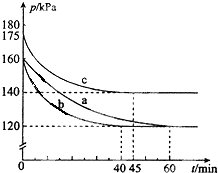
(2)反应PCl3(g)+Cl2(g)?PCl5(g)在容积为10L的密闭容器中进行.起始时PCl3和Cl2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.
①计算实验a从反应开始至达到平衡时的反应速率 v(PCl5)=
②图中3组实验从反应开始至达到平衡时的反应速率v(PCl3)由大到小的次序为
③αa、αb、αc分别表示实验a、b和c PCl5(g)的平衡转化率,比较其相对大小:
考点:化学平衡的计算
专题:
分析:(1)已知PCl3的熔点和沸点分别为-93.6℃和76.1℃,PCl5的熔点为167℃,判断PCl3的状态为液体,PCl5为固体,结合热化学方程式书写方法,标注物质聚集状态和对应反应焓变得到;
(2)气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算,设反应的氯气物质的量为x
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
①图象分析可知实验a气体压强160变化为120,60min达到平衡状态,
气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120
x=0.1mol,依据化学反应速率概念计算;
②分析图象可知达到平衡状态的时间不同,时间越短反应速率越快;其中b和a达到相同平衡状态,但时间不同,说明b是加入了催化剂改变了反应速率;c混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大;
③ab是相同平衡状态,PCl5(g)的平衡转化率相同,反应是放热反应,c是升温,平衡逆向进行,转化率减小.
(2)气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算,设反应的氯气物质的量为x
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
①图象分析可知实验a气体压强160变化为120,60min达到平衡状态,
气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120
x=0.1mol,依据化学反应速率概念计算;
②分析图象可知达到平衡状态的时间不同,时间越短反应速率越快;其中b和a达到相同平衡状态,但时间不同,说明b是加入了催化剂改变了反应速率;c混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大;
③ab是相同平衡状态,PCl5(g)的平衡转化率相同,反应是放热反应,c是升温,平衡逆向进行,转化率减小.
解答:
解:(1)已知PCl3的熔点和沸点分别为-93.6℃和76.1℃,PCl5的熔点为167℃,判断PCl3的状态为液体,PCl5为固体,结合热化学方程式书写方法,标注物质聚集状态和对应反应焓变得到,室温时2molPCl3与气体Cl2完全反应生成PCl5,放出热量257.6kJ,反应的热化学方程式,PCl3(l)+Cl2(g)?PCl5(s)△H=-128.8KJ/mol;
故答案为:PCl3(l)+Cl2(g)?PCl5(s)△H=-128.8KJ/mol;
(2)气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算,设反应的氯气物质的量为x
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
①图象分析可知实验a气体压强160变化为120,60min达到平衡状态,
气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120
x=0.1mol
实验a从反应开始至达到平衡时的反应速率 v(PCl5)=
=
=1.7×10-4mol/L?min,
故答案为:1.7×10-4mol/L?min;
②分析图象可知达到平衡状态的时间不同,时间越短反应速率越快,图中3组实验从反应开始至达到平衡时的反应速率v(PCl3)由大到小的次序b>c>a,与实验a相比,b和a达到相同平衡状态,但时间不同,b组改变的实验条件及判断依据是加入了催化剂改变了反应速率;c混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大;
故答案为:b>c>a,加入催化剂,反应速率加快但不影响化学平衡,温度升高,依据PV=nRT可知,当物质的量和体积一定,压强增大是温度升高引起;
③ab是相同平衡状态,PCl5(g)的平衡转化率相同,反应是放热反应,c是升温,平衡逆向进行,转化率减小,αa、αb、αc分别表示实验a、b和c PCl5(g)的平衡转化率,比较其相对大小为:αa=αb>αc ;
故答案为:αa=αb>αc.
故答案为:PCl3(l)+Cl2(g)?PCl5(s)△H=-128.8KJ/mol;
(2)气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算,设反应的氯气物质的量为x
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
①图象分析可知实验a气体压强160变化为120,60min达到平衡状态,
气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120
x=0.1mol
实验a从反应开始至达到平衡时的反应速率 v(PCl5)=
| △c |
| △t |
| ||
| 60min |
故答案为:1.7×10-4mol/L?min;
②分析图象可知达到平衡状态的时间不同,时间越短反应速率越快,图中3组实验从反应开始至达到平衡时的反应速率v(PCl3)由大到小的次序b>c>a,与实验a相比,b和a达到相同平衡状态,但时间不同,b组改变的实验条件及判断依据是加入了催化剂改变了反应速率;c混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大;
故答案为:b>c>a,加入催化剂,反应速率加快但不影响化学平衡,温度升高,依据PV=nRT可知,当物质的量和体积一定,压强增大是温度升高引起;
③ab是相同平衡状态,PCl5(g)的平衡转化率相同,反应是放热反应,c是升温,平衡逆向进行,转化率减小,αa、αb、αc分别表示实验a、b和c PCl5(g)的平衡转化率,比较其相对大小为:αa=αb>αc ;
故答案为:αa=αb>αc.
点评:本题考查了图象分析判断方法,化学平衡计算分析,影响化学平衡的因素理解应用,反应速率概念的计算,掌握基础是关键,题目难度中等.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A、氯气是合成塑料、橡胶、农药和制盐酸、有机溶剂的重要原料 |
| B、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| C、白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| D、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
下列物质的颜色是白色的是( )
| A、Cu2O |
| B、CuO |
| C、CuSO4 |
| D、Na2O2 |
下列说法正确的是( )
| A、在由水电离产生的氢离子浓度为10-13mol?L-1的溶液中,Ca2+、K4、Cl-、HCO3-四种离子能大量共存 |
| B、已知MgCO3的Ksp=6.82x10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 |
| C、对于反应N2H4(l)=N2(g)+2H2(g);△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| D、常温下,将0.2mol?L-1某一元碱(ROH)溶液和0.1mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
下列说法正确的是( )
| A、常温下,铜与氧气很难反应,因为铜和氧气的反应是吸热反应 |
| B、金属锂在常温和加热情况下与氧气反应的产物不同 |
| C、焰色反应实验中的铂丝应用稀盐酸洗涤 |
| D、用pH试纸测得某浓度氯水的pH为4 |
 酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
