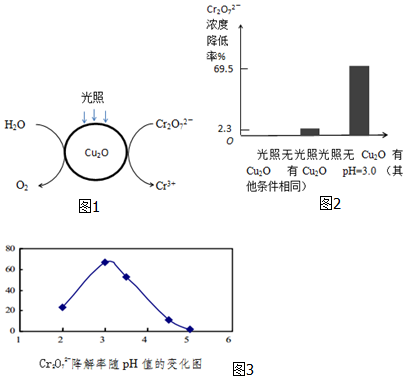
题目内容
4.已知还原性:I->Fe2+>Br-.向含有Cl-、Fe2+、Br-、I-各0.1mol (其余为Na+)的溶液中通入标准状况下的氯气,通入氯气的体积和相关离子的物质的量的关系正确的是( )| A. | 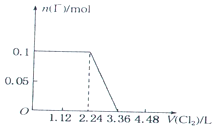 | B. | 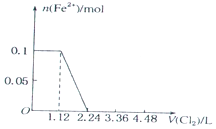 | ||
| C. | 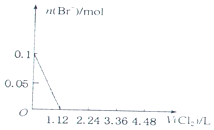 | D. | 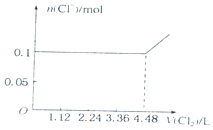 |
分析 离子还原性I->Fe2+>Br-,故首先发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,据此判断.
解答 解:A、0.1molI-完全反应消耗0.05氯气,所以一开始时碘离子的物质的量就减少,故A错误;
B、0.1molI-完全反应消耗0.05氯气,故亚铁离子开始反应时氯气的体积为0.05mol×22.4L/mol=1.12L,由2Fe2++Cl2=2Fe3++2Cl-可知,0.1molFe2+完全反应消耗0.05氯气,故Fe2+完全时消耗的氯气体积为0.1mol×22.4L/mol=2.24L,图象与实际符合,故B正确;
C、开始阶段与还原强的碘离子反应,而不是溴离子,故C错误;
D、只要氧化还原反应发生,氯离子的物质的量就在增大,故D错误;
故选B.
点评 本题以图象形式考查氧化还原反应、有关离子反应计算等,难度中等,确定离子反应发生的先后顺序是解题的关键.

练习册系列答案
相关题目
15.下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
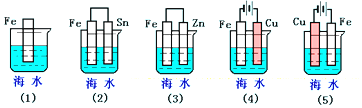

| A. | (5)(2)(1)(3)(4) | B. | (2)(5)(3)(4)(1) | C. | (5)(3)(4)(1)(2) | D. | (1)(5)(3)(4)(2) |
19.下列叙述中,正确的是( )
| A. | 过氧化钠加入到紫色石蕊试液中,紫色石蕊先变红后褪色且有气泡产生 | |
| B. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| C. | 硅、氯、硫、氮、钠元素在自然界只有化合态没有游离态 | |
| D. | 浓硝酸有氧化性,稀硝酸没有氧化性 |
16.下列有关SO2的说法中,不正确的是( )
| A. | 溶于水能导电,属于电解质 | |
| B. | 使品红溶液褪色,有漂白性 | |
| C. | 使酸性高锰酸钾溶液褪色,有还原性 | |
| D. | 能杀菌、消毒,可按照国家标准用作食物的防腐剂 |
14.下列属于碱性氧化物的是( )
| A. | Ca(OH)2 | B. | Na2O | C. | SiO2 | D. | H2SO4 |