题目内容
15.下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )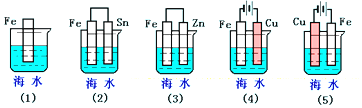
| A. | (5)(2)(1)(3)(4) | B. | (2)(5)(3)(4)(1) | C. | (5)(3)(4)(1)(2) | D. | (1)(5)(3)(4)(2) |
分析 先判断装置是原电池还是电解池,再根据原电池正负极腐蚀的快慢比较,作原电池负极和电解池阳极的金属易被腐蚀,作原电池正极或电解池阴极的金属易被保护,金属腐蚀快慢顺序是:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,(2)(3)装置是原电池,在(2)中,金属铁做负极,(3)中金属铁作正极,做负极的腐蚀速率快,并且两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,并且原电池原理引起的腐蚀>化学腐蚀,所以(2)>(3),
(4)(5)装置是电解池,(4)中金属铁为阴极,(5)中金属铁为阳极,阳极金属被腐蚀速率快,阴极被保护,即(5)>(4),
根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,
所以铁腐蚀快慢顺序为:(5)>(2)>(1)>(3)>(4);
故选:A.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道作原电池负极或电解池阳极的金属易被腐蚀,难度不大.

练习册系列答案
相关题目
6.在某澄清透明的酸性溶液中,能共存的离子组是( )
| A. | NH4+、Cl-、Fe3+、K+ | B. | Na+、SO32-、K+、Cl- | ||
| C. | MnO4-、Fe2+、Na+、SO42- | D. | K+、SO42-、HCO3-、Na+ |
3.根据热化学方程S ( s )+O2 ( g )=SO2 ( g )△H=-297.23kJ/mol (反应在298K,101kPa下发生)分析下列说法不正确的是( )
| A. | 标况下,燃烧1mol S放出的热量为297.23 kJ | |
| B. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量大于297.23 kJ | |
| C. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
10.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 醋酸溶液中加入烧碱溶液:H++OH-═H2O | |
| C. | Ba(OH)2与 H2SO4反应到恰好沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 向澄清的石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
20.下列说法或做法正确的是( )
| A. | 金属钠投入到硫酸铜的溶液中不能置换得到铜单质 | |
| B. | 金属钠着火燃烧时,可以用水灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | 正常雨水PH等于7,酸雨的PH小于7 |
7.下列离子方程式正确的是( )
| A. | 澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 硫酸氢钠碳酸氢钠溶液中加入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+2H2O | |
| C. | 向氢氧化钠溶液中通入足量CO2+2OH-+CO2?CO32-+H2O | |
| D. | 向氢氧化钡溶液中加入过量硫酸:2H++SO42-+Ba2++2OH-?BaSO4↓+2H2O |
4.已知还原性:I->Fe2+>Br-.向含有Cl-、Fe2+、Br-、I-各0.1mol (其余为Na+)的溶液中通入标准状况下的氯气,通入氯气的体积和相关离子的物质的量的关系正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
5.下列说法中正确的是( )
| A. | 1molOH-的质量为17g•mol-1 | |
| B. | 0.5mol H2所占体积约为11.2L | |
| C. | 等质量的金刚石和晶体硅所含原子个数之比为7:3 | |
| D. | 1mol NaCl固体溶于0.5L水中,所得溶液的物质的量浓度为2mol•L-1 |

 ;②
;② ( X=O,N,S;R为烃基); ③RCOOR+2R′OH→R′COOR′+2ROH
( X=O,N,S;R为烃基); ③RCOOR+2R′OH→R′COOR′+2ROH .
. .
. .
. 的合成路线.
的合成路线.