题目内容
14.有一瓶无色澄清溶液,其中可能含有H+、K+、Ba2+、Al3+、Cl-、SO42-、CO32-、MnO4-离子.现进行以下实验:①用pH试纸检验溶液,发现溶液呈强酸性;
②取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,始终无沉淀产生;
③取少量②中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生.
(1)根据上述事实确定:该溶液中肯定存在的离子有H+、Ba2+、Cl-;肯定不存在的离子有SO42-、Al3+、CO32-、MnO4-.
(2)写出③中发生反应的离子方程式Ba2++CO32-=BaCO3↓.
分析 由无色可知一定不含MnO4-,
①用pH试纸检验溶液,发现溶液呈强酸性,则一定含H+,不存在CO32-;
②取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Al3+;
③取少量②中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,沉淀为碳酸钡,则一定含Ba2+,不能存在SO42-,结合电荷守恒来解答.
解答 解:由无色可知一定不含MnO4-,
①用pH试纸检验溶液,发现溶液呈强酸性,则一定含H+,不存在CO32-;
②取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Al3+;
③取少量②中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,沉淀为碳酸钡,则一定含Ba2+,不能存在SO42-,
溶液不显电性,一定含阴离子为Cl-,
(1)综上所述,肯定存在:H+、Ba2+、Cl-;肯定不存在:Al3+、SO42-、CO32-、MnO4-;可能存在:K+,
故答案为:H+、Ba2+、Cl-;Mg2+、SO42-、CO32-、MnO4-;
(2)③中发生反应的离子方程式为:Ba2++CO32-═BaCO3↓,
故答案为:Ba2++CO32-═BaCO3↓.
点评 本题考查无机物的推断,为高频考点,把握离子之间的反应、现象推断离子为解答的关键,侧重分析与推断能力的考查,注意沉淀及电荷守恒的判断,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.丁烷广泛应用于家用液化石油气,也用于打火机中作燃料,下列叙述中不正确的是( )
| A. | 丁烷在常温下是气体 | |
| B. | C4H10与 C(CH3)4 互为同系物 | |
| C. | CH3CH2CH2CH3分子中四个碳原子排列成一条直线 | |
| D. | C4H10进行一氯取代后可生成四种沸点不同的有机产物 |
2.下列图示的实验设计能实现相应实验目的是( )
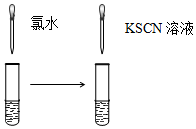
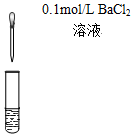
| A.验证FeCl3溶液中是否含有Fe2+ | B.检验溴乙烷消去的产物 |
 | 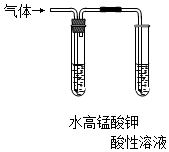 |
| C.检验氯气与亚硫酸钠是否发生反应 | D.对比Fe3+和Cu2+对H2O2分解的催化效果 |
 反应后混合液 | 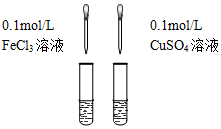 等体积5%的H2O2溶液 |
| A. | A | B. | B | C. | C | D. | D |
9.X、Y、Z、W四种短周期元素,有关数据如表:下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | W和Y形成的化合物为共价化合物 | |
| B. | Y的最高价氧化物对应的水化物为强酸 | |
| C. | Y的简单气态氢化物的沸点高于X的简单气态氢化物 | |
| D. | 工业上经常采用电解Z的氯化物溶液制备Z单质 |
6.在某澄清透明的酸性溶液中,能共存的离子组是( )
| A. | NH4+、Cl-、Fe3+、K+ | B. | Na+、SO32-、K+、Cl- | ||
| C. | MnO4-、Fe2+、Na+、SO42- | D. | K+、SO42-、HCO3-、Na+ |
3.根据热化学方程S ( s )+O2 ( g )=SO2 ( g )△H=-297.23kJ/mol (反应在298K,101kPa下发生)分析下列说法不正确的是( )
| A. | 标况下,燃烧1mol S放出的热量为297.23 kJ | |
| B. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量大于297.23 kJ | |
| C. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |

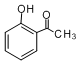 ;②
;②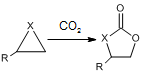 ( X=O,N,S;R为烃基); ③RCOOR+2R′OH→R′COOR′+2ROH
( X=O,N,S;R为烃基); ③RCOOR+2R′OH→R′COOR′+2ROH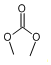 .
.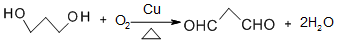 .
.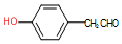 .
.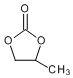 的合成路线.
的合成路线.