题目内容
3.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16.下列关于不溶物之间转化的说法中错误的是( )| A. | 向AgI中加一定浓度、一定体积的NaCl溶液,AgI可转化为AgCl | |
| B. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度应该大于$\frac{1}{\sqrt{1.8}}$×10-11mol/L | |
| C. | AgI比AgCl更难溶于水,AgCl可以转化为AgI | |
| D. | 向c(Ag+)=1.8×10-4mol/L的溶液中加入等体积NaCl溶液,开始出现AgCl沉淀,则NaCl溶液浓度应大于1.0×10-6mol/L |
分析 A.如满足c(Cl-)×c(Ag+)>Ksp,则可生成AgCl沉淀;
B.根据Ksp(AgCl)求出c(Ag+),再利用Ksp(AgI)求出碘离子的浓度;
C.根据沉淀转化原理分析;
D.向c(Ag+)=1.8×10-4mol/L的溶液中加入等体积NaCl溶液,c(Ag+)变为0.9×10-4mol/L.
解答 解:A.如加入NaCl浓度较大,满足c(Cl-)×c(Ag+)>Ksp,则可生成AgCl沉淀,故A正确;
B.已知Ksp(AgCl)=1.8×10-10,则c(Ag+)=$\sqrt{Ksp(AgCl)}$=$\sqrt{1.8×1{0}^{-10}}$,c(I-)=$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{1.0×1{0}^{-16}}{\sqrt{1.8×1{0}^{-10}}}$=$\frac{1}{\sqrt{1.8}}$×10-11mol/L,故B正确;
C.根据沉淀转化原理:溶解度小的能转化为溶解度更小的,所以AgCl可以转化为AgI,故C正确;
D.向c(Ag+)=1.8×10-4mol/L的溶液中加入等体积NaCl溶液,c(Ag+)变为0.9×10-4mol/L,出现AgCl沉淀,则NaCl溶液浓度应大于2.0×10-6mol/L,故D错误.
故选D.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握溶度积的运用以及相关计算,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.某同学通过一系列实验探究Cu及其化合物的性质,操作正确且能达到目的是( )
| A. | 将铜粉与硫粉混合均匀加热以制取CuS | |
| B. | 将铜丝插入浓硫酸中并加热,反应后再加水以观察CuSO4溶液的颜色 | |
| C. | 向CuSO4溶液中加入过量的NaOH溶液,过滤洗涤并收集沉淀充分灼烧以制取CuO | |
| D. | 向淀粉溶液中加入适量稀硫酸微热,再加少量新制Cu(OH)2并加热,产生砖红色沉淀 |
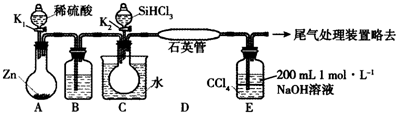
8. NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为H2PO4-?HPO42-+H+.
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为HPO42-+H2O?H2PO4-+OH-.
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
样品1.3000g$\stackrel{稀硝酸}{→}$H3PO4$→_{调pH到3-4}^{用NaOH(aq)}$NaH2PO4→$\stackrel{配成100.00mL}{溶液A}$$\stackrel{取样}{→}$$→_{指示剂X}^{0.1000mol.L-1NaOH溶液滴}$Na2HPO4
1滴定时所用的指示剂X可为酚酞.
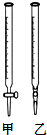
②NaOH标准溶液应盛放在如图所示的滴定管乙(选填:“甲”或“乙”) 中.
③滴定实验记录如下表(样品中杂质不与酸或碱反应).
计算样品中Na5P3O10的质量分数75.5%(不要求列出计算过程,结果保留三位有效数字).
 NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为H2PO4-?HPO42-+H+.
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为HPO42-+H2O?H2PO4-+OH-.
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
样品1.3000g$\stackrel{稀硝酸}{→}$H3PO4$→_{调pH到3-4}^{用NaOH(aq)}$NaH2PO4→$\stackrel{配成100.00mL}{溶液A}$$\stackrel{取样}{→}$$→_{指示剂X}^{0.1000mol.L-1NaOH溶液滴}$Na2HPO4
1滴定时所用的指示剂X可为酚酞.
②NaOH标准溶液应盛放在如图所示的滴定管乙(选填:“甲”或“乙”) 中.
③滴定实验记录如下表(样品中杂质不与酸或碱反应).
| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol•L-1NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
15.已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A. | 向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 | |
| D. | 将AgCl加入到较浓的KI溶液中,AgCl能转化为AgI |
 .
.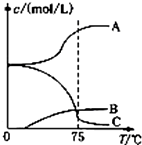 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.