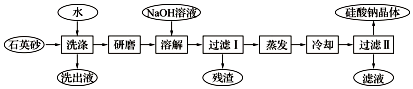
题目内容
2.下列工业制法和生产中,说法正确的是( )| A. | 金属钠可以从四氯化钛溶液中置换出金属钛 | |
| B. | 工业制备和提纯硅的三步化学反应都是氧化还原反应 | |
| C. | 镁的提取中将氯化镁溶液蒸发结晶可直接获得无水氯化镁,电解熔融无水氯化镁得到金属镁 | |
| D. | 硫酸的工业制法中,依次使用的三种设备是沸腾炉,接触室,吸收塔 |
分析 A、钠与四氯化钛溶液反应时置换出氢气,不会生成钛;
B、①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,反应前后有元素化合价变化; ②Si+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4 反应前后有化合价变化; ③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl,反应前后有元素化合价变化;
C、氯化镁是强酸弱碱盐,蒸发结晶得到氢氧化镁;
D、根据工业制硫酸的三设备:沸腾炉、接触室和吸收塔.
解答 解:A、钠与四氯化钛溶液反应时,钠优先与水反应,不会置换出金属钛,而是钠与熔融的四氯化钛反应生成单质钛,故A错误;
B、①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,反应前后有元素化合价变化; ②Si+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4 反应前后有化合价变化; ③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl,反应前后有元素化合价变化,所以都是氧化还原反应,故B正确;
C、氯化镁是强酸弱碱盐,蒸发结晶得到氢氧化镁,所以在氯化氢的氛围中蒸发结晶可直接获得无水氯化镁,故C错误;
D、工业制硫酸的三设备是:沸腾炉、接触室和吸收塔,故D正确;
故选BD.
点评 本题考查了海水资源的开发和利用,涉及金属的冶炼氧化还原反应等知识点,根据金属的活动性强弱与冶炼方法的选取、电解原理、物质的性质等知识点来分析解答,注意由带结晶水的氯化镁制取氯化镁的条件,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.室温下,向100mL 0.1mol/L NH4Cl溶液中加入下列物质.有关结论正确的是( )
| 加入的物质 | 结论 | |
| A. | 100 mL 0.1 mol/L盐酸 | 溶液中2c=c(Cl-) |
| B. | 0.01 mol Na2O2固体 | 反应完全后,溶液pH增大,c(Na+)=2c(Cl-) |
| C. | 100 mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D. | 100 mL 0.1 mol/L NH3•H2O | 溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$减小 |
| A. | A | B. | B | C. | C | D. | D |
10.下列有关Na2CO3和NaHCO3比较中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度下,0.1mol•L-1盐溶液的pH值:Na2CO3>NaHCO3 | |
| C. | 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应放出气体的量:Na2CO3<NaHCO3 | |
| D. | 相同温度下,0.1mol•L-1盐溶液分别与0.1mol•L-1HCl反应的剧烈程度:Na2CO3>NaHCO3 |
17.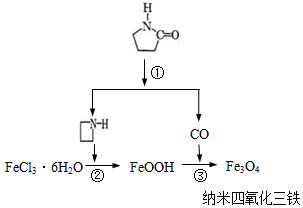 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )| A. | 在反应②中,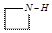 的作用可能是促进氯化铁水解 的作用可能是促进氯化铁水解 | |
| B. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 | |
| C. | 直接加热FeCl3溶液也可以得到四氧化三铁 | |
| D. | 纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象 |
7.下列仪器名称为“蒸馏烧瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
14.短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是( )
| W | X | ||
| Y | Z |
| A. | Z元素的最高价氧化物水化物的酸性强于Y | |
| B. | 由W元素形成的分子W2中存在三个共价键 | |
| C. | 四种元素常见的氢化物:YH4、WH3、H2X、HZ中,YH4最稳定 | |
| D. | 氢化物WH3与HZ反应生成的离子化合物中存在10e-、18 e-两种微粒 |
20.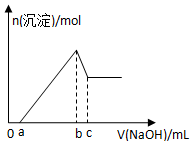 某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
 某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加入NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )| A. | 一定没有NO3- | B. | 可能有K+、NO3-、SO42- | ||
| C. | 不能确定是否含有K+、NO3- | D. | 一定有Mg2+、Al3+、Cl-、SO42- |