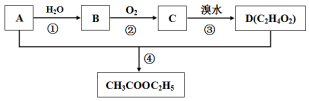
题目内容
13.硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一.下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图: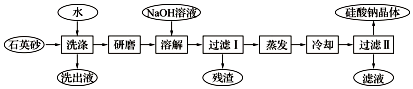
(1)要将洗出液中的溶质析出,采用的方法是蒸发(填“蒸发”、“降温”)结晶;操作时用到的硅酸盐仪器有酒精灯(再填2个仪器)蒸发皿、玻璃棒.
(2)残渣的主要成分为:氧化铁.
(3)上述流程中加入NaOH溶液,反应的离子方程式为SiO2+2OH-═SiO32-+H2O.
分析 石英砂中含有NaCl、Fe2O3等杂质,NaCl能溶于水,而石英砂和Fe2O3不能溶于水,所以洗出液中含有NaCl,滤渣中含有Fe2O3和SiO2,研磨滤渣,向滤渣中加入NaOH溶液,发生反应SiO2+2OH-═SiO32-+H2O,然后过滤得到滤渣Fe2O3,将滤液蒸发浓缩、冷却结晶得到硅酸钠晶体,滤液中含有硅酸钠和NaOH,由此分析解答;
解答 解:石英砂中含有NaCl、Fe2O3等杂质,NaCl能溶于水,而石英砂和Fe2O3不能溶于水,所以洗出液中含有NaCl,滤渣中含有Fe2O3和SiO2,研磨滤渣,向滤渣中加入NaOH溶液,发生反应SiO2+2OH-═SiO32-+H2O,然后过滤得到滤渣Fe2O3,将滤液蒸发浓缩、冷却结晶得到硅酸钠晶体,滤液中含有硅酸钠和NaOH;
(1)将洗出液中的溶质析出,采用的方法是蒸发;玻璃中含有硅酸盐,所以蒸发时需要的玻璃仪器蒸发皿、玻璃棒和酒精灯,故答案为:蒸发;蒸发皿、玻璃棒)(2)残渣的主要成分为:氧化铁,故答案为:氧化铁;
(3)二氧化硅和NaOH反应生成可溶性的硅酸钠,离子方程式为SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O.
点评 本题考查物质的分离和提纯,侧重考查基本实验操作、元素化合物性质,知道流程图中各个过程发生的反应、基本操作方法及实验仪器,题目难度中等.

练习册系列答案
相关题目
3.下列物质的颜色按“红、橙、黄、绿、蓝、紫”顺序排列的是( )
①CuSO4•5H2O ②S ③溴水 ④FeCl2溶液⑤KMnO4溶液 ⑥硫氰化铁溶液.
①CuSO4•5H2O ②S ③溴水 ④FeCl2溶液⑤KMnO4溶液 ⑥硫氰化铁溶液.
| A. | ⑥③①②④⑤ | B. | ⑤④③①②⑥ | C. | ⑥③②④①⑤ | D. | ②③①④⑤⑥ |
4.下列有关物质用途的说法,正确的是( )
| A. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 | |
| B. | 石英可用于制电脑芯片 | |
| C. | 纯碱可用于治疗胃酸过多 | |
| D. | 过氧化钠可用作于潜艇的供氧剂 |
1.某原子的一种激发态为1s22s12p1,则该元素在周期表中的位置为( )
| A. | 第二周期ⅡA族 | B. | 第二周期ⅢA族 | C. | 第二周期ⅠA族 | D. | 第二周期ⅣA族 |
8.工业上曾经通过反应“3Fe+4NaOH=Fe3O4+2H2↑+4Na↑”生产金属钠.下列有关说法正确的是( )
| A. | 不能用磁铁将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 该反应中每生成2 mol H2,转移的电子数约为4×6.02×1023 |
18.下列化学用语表述正确的是( )
| A. | 钠离子的电子式:Na+ | B. | 二甲醚的分子式:CH3OCH3 | ||
| C. | CO2分子的比例模型: | D. | 16O原子的结构示意图: |
2.下列工业制法和生产中,说法正确的是( )
| A. | 金属钠可以从四氯化钛溶液中置换出金属钛 | |
| B. | 工业制备和提纯硅的三步化学反应都是氧化还原反应 | |
| C. | 镁的提取中将氯化镁溶液蒸发结晶可直接获得无水氯化镁,电解熔融无水氯化镁得到金属镁 | |
| D. | 硫酸的工业制法中,依次使用的三种设备是沸腾炉,接触室,吸收塔 |
11.下列是有关实验现象与分析或结论都正确的是( )
| 实验现象 | 分析或结论 | |
| A | 光照新制氯水有气泡冒出 | 氯水含有Cl2,光照Cl2逸出 |
| B | 液氯滴到干燥的有色布条会褪色 | 液氯中的次氯酸具有漂白性 |
| C | 往NaHCO3固体加入新制氯水,有无色无味的气体产生 | 氯水中含有盐酸与NaHCO3反应,产生CO2 |
| D | 新制氯水放置数天后,pH值将增大 | 氯化氢具有挥发性,酸性减弱 |
| A. | A | B. | B | C. | C | D. | D |