题目内容
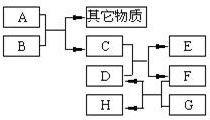 已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.
已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.(1)请根据以上关系进行判断,指出下列物质的化学式:
A
(2)写出下列反应的化学方程式:
C+D:
A+B:
在A和B的反应中,A显示出来的性质是
①只有还原性; ②还原性和酸性; ③只有氧化性; ④氧化性和酸性
(3)C还能由以下反应制得:KClO3+6HCl=KCl+3Cl2↑+3H2O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为
考点:无机物的推断
专题:推断题
分析:D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,则均含K元素,B为黑色粉末,则B为MnO2,A应为浓盐酸,则C为Cl2,F为深红棕色液体,H能使淀粉变蓝,F为Br2,H为I2,则D为KBr,E为KCl,G为KI,符合上述转化,以此来解答.
解答:
解:D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,则均含K元素,B为黑色粉末,则B为MnO2,A应为浓盐酸,则C为Cl2,F为深红棕色液体,H能使淀粉变蓝,F为Br2,H为I2,则D为KBr,E为KCl,G为KI,符合上述转化,
(1)由上述分析可知,A为HCl,C为Cl2,D为KBr,G为KI,故答案为:HCl;Cl2;KBr;KI;
(2)C+D的反应为Cl2+2KRr=2KCl+Br2,A+B为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,该反应生成氯化锰体现盐酸的酸性,生成氯气体现盐酸的还原性,②符合,
故答案为:Cl2+2KRr=2KCl+Br2;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;②;
(3)KClO3+6HCl=KCl+3Cl2↑+3H2O中,Cl元素的化合价由-1价升高为0,失去电子被氧化,5molHCl作还原剂;Cl元素的化合价由+5价降低为0,得到电子被还原,1molKClO3作氧化剂,由电子守恒可知,被氧化的氯元素与被还原的氯元素的物质的量之比为5:1,
故答案为:5:1.
(1)由上述分析可知,A为HCl,C为Cl2,D为KBr,G为KI,故答案为:HCl;Cl2;KBr;KI;
(2)C+D的反应为Cl2+2KRr=2KCl+Br2,A+B为MnO2+4HCl(浓)
| ||
故答案为:Cl2+2KRr=2KCl+Br2;MnO2+4HCl(浓)
| ||
(3)KClO3+6HCl=KCl+3Cl2↑+3H2O中,Cl元素的化合价由-1价升高为0,失去电子被氧化,5molHCl作还原剂;Cl元素的化合价由+5价降低为0,得到电子被还原,1molKClO3作氧化剂,由电子守恒可知,被氧化的氯元素与被还原的氯元素的物质的量之比为5:1,
故答案为:5:1.
点评:本题考查无机物的推断,侧重于学生的分析能力的考查,为高频考点,注意把握题中转化关系和题给信息为解答该题的关键,侧重卤素单质置换反应及氯气实验室制法的考查,注意把握相关基础知识的学习,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol?L-1.下列判断错误的是( )
| A、x=1 |
| B、2min内A的反应速率为0.3mol?L-1?min-1 |
| C、B的转化率为50% |
| D、若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态 |
下列说法正确的是( )


| A、已知常温下,物质的量浓度相等的CH3COONa与CH3COOH混合液的pH<7,在此溶液中继续加CH3COONa至pH=7,测得此时c(Na+ )=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| B、0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH- HPO42-?H++PO43- 且溶液pH>7;加水稀释后溶液中HPO42-、PO43-、H+的浓度均减小 |
| C、图中,Y轴S表示相应金属氢氧化物在饱和溶液中阳离子的浓度,由图中数据可计算出室温下Ksp[Cu(OH)2]=1.0×10-12 |
| D、由图可知,若Fe(NO3)3溶液中含有少量的Co2+杂质,可通过加入Fe(OH)3的方法来除去 |
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作.下列图示对应的装置合理、操作规范的是( )
A、 灼烧 |
B、 过滤 |
C、 分液 |
D、 蒸馏 |
已知298K时,Mg(OH)2的容度积常数KKsp=5.6×10-12,MgCO3容度积常数KKsp=6.8×10-6,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
| A、298K时在水中溶解能力Mg(OH)2弱于MgCO3 |
| B、MgCO3悬浊液中加入适量的烧碱溶液可以生成Mg(OH)2沉淀 |
| C、沉淀溶解平衡时溶液中的c(Mg2+)=5.6×10-10mol?L-1 |
| D、298时饱和Mg(OH)2溶液与饱和MgCO3溶液相比前者的c(Mg2+)大 |
 将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.