题目内容
4.30mL某浓度的盐酸与24mL某浓度的NaOH溶液恰好中和,若将0.04mol/LBa(OH)2溶液16mL加入到30mL这种盐酸中,剩余盐酸还需用8mL这种NaOH溶液方能中和,求这种盐酸和NaOH溶液的物质的量浓度各是多少?分析 根据题意由Ba(OH)2的物质的量可以计算出消耗盐酸的物质的量,又因为剩余盐酸还需用8mL这种NaOH溶液方能中和,再由NaOH的物质的量计算出消耗盐酸的物质的量,两者反应消耗盐酸的总物质的量即为题干中参加反应的盐酸总物质的量建立起等式①.由“30mL某浓度的盐酸与24mL某浓度的NaOH溶液恰好中和”方可建立起等式②,将①②联立方程在可解出盐酸和NaOH溶液的物质的量浓度.
解答 解:设盐酸浓度为 x,NaOH 浓度为 y.
∵2HCl+Ba(OH)2=BaCl2 +2 H2O
2 1
0.016×0.04 n1(HCl )
∴n1(HCl )=2n(Ba(OH)2)=0.016×0.08mol
∵HCl+NaOH=NaCl+H2O
1 1
n2(HCl) 8y,
∴n2(HCl )=n(NaOH)=8y
则此过程消耗的盐酸总物质的量为n总(HCl )=n1(HCl )+n2(HCl)=0.016×0.08+8y,
这与30mL某浓度的盐酸的物质的量相等即30x=0.016×0.08+8①
又因为30mL某浓度的盐酸与24mL某浓度的NaOH溶液恰好中和即30x=24y②,
将①②联立方程组得 x=0.064 y=0.08,
答:盐酸浓度为 0.064mol/L,NaOH 浓度为 0.08 mol/L.
点评 本题考查物质的量浓度和体积的计算,难度稍微有点大,正确书写化学方程式并根据化学方程式进行计算也是解题的关键

练习册系列答案
相关题目
20.化学在生活中有着广泛的应用,下列对应关系错误的是(
| 选项 | 化学性质 | 实际应用 |
| A | ClO2具有强氧化性 | 自来水消毒杀菌 |
| B | SO2具有还原性 | 用作漂白剂 |
| C | NaHCO3受热易分解并且生成气体 | 焙制糕点 |
| D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
12.温度700℃时,向容积为1L的密闭容器中充入一定量的CO和H2O发生反应CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t1<t2).下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 0.60 | 0.30 |
| t1 | 0.40 | |
| t2 | 0.10 |
| A. | 反应在t1min内的平均速率为v(H2)=0.20/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.10molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| C. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| D. | 700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则此时该反应v(正)<v(逆) |
16.化学与人类的生活,生产密切相关,下列说法中正确的是( )
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 埃博拉病毒可用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理相同 | |
| C. | 纯碱是属于碱类、谷氨酸一钠(C5H8NO4Na,味精)属于盐类 | |
| D. | 压缩天然气(CNG)、液化石油气(LPG)的主要成分是烃类,是城市推广的清洁燃料 |
13.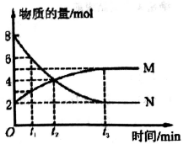 一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图.下列说法正确的是( )
一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图.下列说法正确的是( )
 一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图.下列说法正确的是( )
一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图.下列说法正确的是( )| A. | M、N之间转化的反应方程式为M=2N | |
| B. | t2时刻,反应达到平衡,正、逆反应速率达到相等 | |
| C. | t3时刻,M的反应速率为$\frac{3}{2{t}_{3}}$mol•L-1•min-l | |
| D. | t1时刻,在容器内气体M和N的物质的量浓度之比为1:2 |
1.某兴趣小组利用以下实验装置模拟工业炼铁的主要过程:
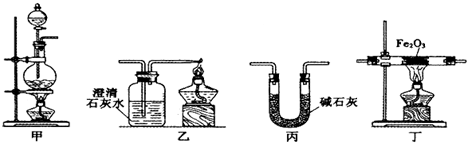
(1)装置甲中发生的反应为:HCOOH(甲酸)$→_{△}^{浓硫酸}$CO↑+H2O.已知甲酸是一种无色有刺激性气味的液体.制取一氧化碳时应该a(填字母).
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→丙→丁→乙
(3)丙装置中碱石灰的作用是除去一氧化碳中的甲酸和水蒸气.
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为丁甲乙.
(5)为了探究影响反应产物的外界因素,在Fe2O3与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
①甲同学猜想黑色产物中可能含有碳单质.乙同学排除了该可能,他提出的两种理由是:碳单质不会被磁铁吸引、从氧化还原角度分析不可能生成碳单质等.
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.全部为四氧化三铁;iii.四氧化三铁和铁的混合物.

(1)装置甲中发生的反应为:HCOOH(甲酸)$→_{△}^{浓硫酸}$CO↑+H2O.已知甲酸是一种无色有刺激性气味的液体.制取一氧化碳时应该a(填字母).
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→丙→丁→乙
(3)丙装置中碱石灰的作用是除去一氧化碳中的甲酸和水蒸气.
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为丁甲乙.
(5)为了探究影响反应产物的外界因素,在Fe2O3与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
| 加热方式 | 通CO加热 时间/min | 澄清石灰水变 浑浊时间/min | 产物颜色 | 产物能否全部 被磁铁吸引 |
| 酒精灯 | 30 | 5 | 黑色 | 能 |
| 酒精喷灯 | 30 | 1 | 黑色 | 能 |
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.全部为四氧化三铁;iii.四氧化三铁和铁的混合物.
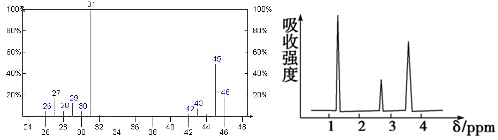
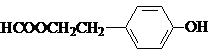 (写结构简式).
(写结构简式).