题目内容
20.化学在生活中有着广泛的应用,下列对应关系错误的是(| 选项 | 化学性质 | 实际应用 |
| A | ClO2具有强氧化性 | 自来水消毒杀菌 |
| B | SO2具有还原性 | 用作漂白剂 |
| C | NaHCO3受热易分解并且生成气体 | 焙制糕点 |
| D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.具有强氧化性,可用于杀菌消毒;
B.做漂白剂与漂白性有关;
C.NaHCO3不稳定,与酸反应生成二氧化碳气体;
D.氢氧化铝分解吸收热量.
解答 解:A.ClO2具有强氧化性,可使蛋白质变性,可用于杀菌消毒,故A正确;
B.做漂白剂与漂白性有关,与还原性无关,故B错误;
C.NaHCO3不稳定,与酸反应生成二氧化碳气体,可用于焙制糕点,故C正确;
D.氢氧化铝分解吸收热量,可用于阻燃剂,故D正确.
故选B.
点评 本题考查物质的性质与应用,为高考常见题型和高频考点,侧重考查学生的双基的掌握,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
相关题目
10.化学与生活密切相关,下列说法不正确的是( )
| A. | 禁止或少放烟花炮竹、绿色出行可缓解雾霾天气的形成 | |
| B. | 在制作腊肉或香肠时,可加入过量的亚硝酸钠以保持肉类新鲜 | |
| C. | “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 | |
| D. | 盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可降低土壤的碱性 |
11.下列说法不正确的是( )
| A. | 煤和石油燃烧不完全时可排放出大量烟尘和CO | |
| B. | 化石燃料燃烧排出废气中含SO2,直接排到大气中会污染空气并形成酸雨 | |
| C. | 可通过物理方法把化石燃料转化为洁净燃料 | |
| D. | 氢能、核能、太阳能等都属于洁净、高效的新能源 |
8.下列关于有机化合物的说法正确的是( )
| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 乙酸溶于水可以电离,属于离子化合物 | |
| D. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
5.钴及其化合物可应用与催化剂、电池、颜料与染料等.
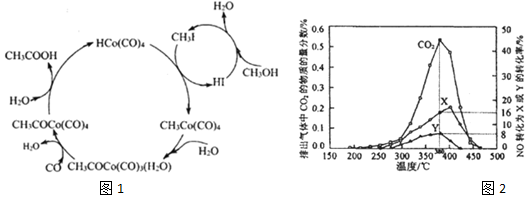
(1)CoO是一种油漆添加剂,可通过反应①②制备.
①2Co(s)+O2(g)═2CoO(s)△H1=akJ•mol-1
②2CoCO3(s)═CoO(s)+CO2 (g)△H2=akJ•mol-1
则反应2Co(s)+O2(g)+2CO2(g)═2CoO3(s) 的△H=(a-2b)kJ•mol-1
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2?C6+LiCoO2
①电池放电时,负极的电极反应式为,Li+向正极移动(填“正极”或“负极“).
②一种回收电极中Co元素的方法是:将LiCoO2与H2O2、H2SO4反应生成CoSO4.该反应的化学方程式为2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+4H2O+O2↑
(3)BASF高压法制备醋酸采用钴碘催化循环过程如图1所示,该循环的总反应方程式为CO+CH3OH→CH3COOH(反应条件无需列出)
(4)某含钴催化剂可同时催化去除柴油车尾气中的碳烟(C)和NOx.不同温度下,将10mol模拟尾气(成分如图2所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如表
①380℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为N2O.
②实验过程中采用NO模拟NOx,而不采用NO2的原因是NO较NO2稳定,NO2气体中存在N2O4,不便于定量测定.

(1)CoO是一种油漆添加剂,可通过反应①②制备.
①2Co(s)+O2(g)═2CoO(s)△H1=akJ•mol-1
②2CoCO3(s)═CoO(s)+CO2 (g)△H2=akJ•mol-1
则反应2Co(s)+O2(g)+2CO2(g)═2CoO3(s) 的△H=(a-2b)kJ•mol-1
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2?C6+LiCoO2
①电池放电时,负极的电极反应式为,Li+向正极移动(填“正极”或“负极“).
②一种回收电极中Co元素的方法是:将LiCoO2与H2O2、H2SO4反应生成CoSO4.该反应的化学方程式为2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+4H2O+O2↑
(3)BASF高压法制备醋酸采用钴碘催化循环过程如图1所示,该循环的总反应方程式为CO+CH3OH→CH3COOH(反应条件无需列出)
(4)某含钴催化剂可同时催化去除柴油车尾气中的碳烟(C)和NOx.不同温度下,将10mol模拟尾气(成分如图2所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如表
| 模拟尾气 | 气体 | 碳烟 | ||
| NO | O2 | He | ||
| 物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |
②实验过程中采用NO模拟NOx,而不采用NO2的原因是NO较NO2稳定,NO2气体中存在N2O4,不便于定量测定.
