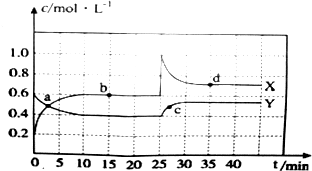
题目内容
5.将30mL0.5mol/LH2SO4溶液加水稀释到500mL,稀释后溶液中H+的物质的量浓度为( )| A. | 0.03mol/L | B. | 0.04mol/L | C. | 0.05mol/L | D. | 0.06mol/L |
分析 先根据稀释过程中溶质的物质的量不变计算出稀释后硫酸的物质的量浓度,然后根据硫酸的化学计算计算出稀释后溶液中氢离子浓度.
解答 解:将30mL0.5mol/LH2SO4溶液加水稀释到500mL,稀释过程中硫酸的物质的量不变,则稀释后硫酸的浓度为:c=$\frac{0.5mol/L×0.03L}{0.5L}$=0.03mol/L,
则稀释后溶液中H+的物质的量浓度为:0.03mol/L×2=0.06mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确稀释定律为解答关键,注意掌握物质的量浓度的表达式及计算方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
15.图是实验室制备氯气并进行一系列相关实验的装置.
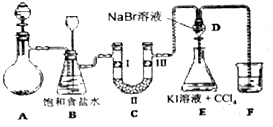
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
(4)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱,当向D中缓慢通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,下层(CCl4层)为紫红色,该现象不能(填“能”或“不能”)说明Br2的氧化性强于I2.
(5)多余的Cl2用氢氧化钠吸收的离子方程式为Cl2+2OH-=ClO-+H2O.

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)多余的Cl2用氢氧化钠吸收的离子方程式为Cl2+2OH-=ClO-+H2O.
16.下列叙述正确的是( )
| A. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 | |
| B. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 |
13.关于0.1mol•L-1 NaHCO3溶液,下列说法正确的是( )
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 微粒浓度关系:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
17.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,
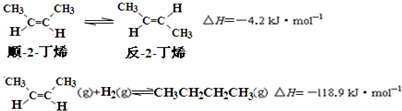
下列说法正确的是( )

下列说法正确的是( )
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: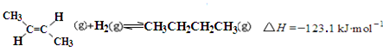 |