题目内容
13.关于0.1mol•L-1 NaHCO3溶液,下列说法正确的是( )| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 微粒浓度关系:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
分析 A.碳酸氢钠溶液中碳酸氢根离子水解生成碳酸和氢氧根离子,选项中是电离方程式;
B.溶液中存在电荷守恒分析;
C.碳酸氢根离子水解显碱性,碳酸氢根离子电离程度小于水解程度;
D.溶液中电荷守恒和物料守恒计算分析判断;
解答 解:A.碳酸氢钠溶液中碳酸氢根离子水解生成碳酸和氢氧根离子,HCO3-+H2O?H2CO3+OH-,故A错误;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故B错误;
C.碳酸氢根离子水解显碱性,碳酸氢根离子电离程度小于水解程度,离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D.溶液中电荷守恒和物料守恒计算分析判断,c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),得到微粒浓度关系:c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故D正确;
故选D.
点评 本题考查了盐类水解原理、离子浓度大小、电解质溶液中物料守恒和电荷守恒的计算分析判断,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
4.为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法均正确的是( )
| 物质 | 除杂试剂 | 分离方法 | |
| A | 硫酸亚铁溶液(硫酸铜) | 铁粉 | 结晶 |
| B | BaSO4(BaCO3) | 盐酸 | 过滤 |
| C | NaCl溶液(I2) | 乙醇 | 分液 |
| D | 铁粉(铜粉) | 硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
8.25℃时,水中存在电离平衡:2H2O?H3O++OH-△H>0.下列叙述正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量NH4Cl固体,抑制水的电离 | |
| C. | 向水中加入少量NaOH固体,促进水的电离 | |
| D. | 向水中加入少量NaHSO4固体,抑制水的电离,c(H+)增大,Kw不变 |
5.将30mL0.5mol/LH2SO4溶液加水稀释到500mL,稀释后溶液中H+的物质的量浓度为( )
| A. | 0.03mol/L | B. | 0.04mol/L | C. | 0.05mol/L | D. | 0.06mol/L |
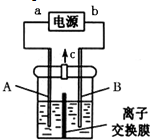 加“碘”食盐实际添加的是碘酸钾.以石墨和铁为电极,以KI溶液为电解液在一定条件下电解可制得KIO3,其简易装置如图所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通电前若加入少量淀粉溶液,通电后发现右侧溶液变蓝色,一段时间后蓝色逐渐变浅.
加“碘”食盐实际添加的是碘酸钾.以石墨和铁为电极,以KI溶液为电解液在一定条件下电解可制得KIO3,其简易装置如图所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通电前若加入少量淀粉溶液,通电后发现右侧溶液变蓝色,一段时间后蓝色逐渐变浅.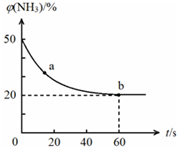 合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.
合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.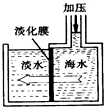 我国有较长的海岸线,浩渺的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.
我国有较长的海岸线,浩渺的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.