题目内容
11.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出.
(2)表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液的洗气装置,其作用是除去CO2中混合的HCl气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.
分析 由制备实验装置可知,A中发生CaCO3+2H+=Ca2++CO2↑+H2O,B中发生NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,为防止氨气与挥发的HCl反应,最好在A、B之间加盛有碳酸氢钠溶液的洗气瓶,结合溶解度可知,B中冷水冷却可析出NaHCO3,C中浓硫酸可吸收逸出的氨气,以此来解答.
解答 解:(1)A装置中发生的反应是碳酸钙与盐酸反应生成二氧化碳和氯化钙、水,所发生反应的离子方程式为CaCO3+2H+=Ca2++CO2+H2O;因为该反应用到液氨,氨气易挥发,所以装置C中浓硫酸的作用是吸收从B装置中的试管内逸出的氨气,减少对环境的污染,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;吸收从B装置中的试管内逸出;
(2)根据表中数据可知碳酸氢钠的溶解度随温度降低减小的较多,所以在冰水中有利于碳酸氢钠的析出,故答案为:温度越低,碳酸氢钠的溶解度越小,便于析出;
(3)二氧化碳的制取用到的盐酸易挥发出HCl,HCl若与氨气反应生成氯化铵,则反应中无碳酸氢钠生成,所以应除去二氧化碳中的HCl,在A与B之间加一个盛有碳酸氢钠饱和溶液的洗气瓶即可,
故答案为:A与B;饱和NaHCO3溶液;除去CO2中混合的HCl气体;
(4)5.85gNaCl的物质的量是0.1mol,若完全转化为碳酸氢钠,根据元素守恒,则生成碳酸氢钠的物质的量也是0.1mol,则碳酸氢钠的质量是0.1mol×84g/mol=8.4g,所以碳酸氢钠的产率为$\frac{5.04g}{8.4g}$×100%=60%,
故答案为:60%.
点评 本题考查物质制备实验,为高频考点,把握物质制备原理、装置的作用、守恒法进行产率计算等为解答的关键,侧重分析、实验及计算能力的综合考查,题目难度中等.

| A. | 硅酸盐是良好的半导体材料 | B. | 硅是地壳中含量最多的元素 | ||
| C. | SiO2不溶于水,也不溶于任何酸 | D. | 二氧化硅用于制作光导纤维 |
①NH3 ②N2 ③N2O3 ④N2O5 ⑤NO2.
| A. | ①和② | B. | ③和④ | C. | ④和⑤ | D. | 只有③ |
| A. | 低碳生活(low-carbon life)是一种时尚的生活理念,倡导减少温室气体排放,CO2、CH4等是常见的温室气体 | |
| B. | 新型无机非金属材料用途广泛,人造刚玉用做高温炉管、氮化硅陶瓷可用于制造柴油机发动机部件 | |
| C. | 推广可利用太阳能、风能的城市照明系统,积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料,利于发展低碳经济、循环经济 | |
| D. | “显世闻名”的奶粉事件中污染物为三聚氰胺(结构如图),其摩尔质量为126g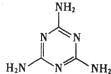 |
| A. | 16 g O2中含有的氧分子数为NA | |
| B. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 1 mol•L-1 CaCl2溶液中含有的氯离子数为NA |
| A. | 配制5% NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1mol•L-1 Na0H溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1mol•L-1 Na2CO3溶液500mL,将Na2CO3放在托盘天平右盘称量 |
 (g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
(g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$ (g)+3H2(g)
(g)+3H2(g)