题目内容
2.亚硝酸在化学反应中既可作氧化剂又可作还原剂,在亚硝酸(HNO2)作氧化剂时,可能生成的产物是( )①NH3 ②N2 ③N2O3 ④N2O5 ⑤NO2.
| A. | ①和② | B. | ③和④ | C. | ④和⑤ | D. | 只有③ |
分析 亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作氧化剂时,N元素的化合价应降低,以此来解答.
解答 解:亚硝酸中N元素的化合价为+3价,当它在反应中作氧化剂时,N元素的化合价应降低,可以降为0价、-3价,则①和②符合.
故选A.
点评 本题考查氧化还原反应,为高频考点,明确还原剂中元素的化合价升高及各物质中元素的化合价是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
12.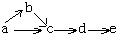 a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a 是单质;b在通常状况下是气体; c、d都是氧化物;e是该元素的最高价
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a 是单质;b在通常状况下是气体; c、d都是氧化物;e是该元素的最高价
氧化物对应水化物,且是一种强电解质,则a可能是( )
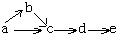 a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a 是单质;b在通常状况下是气体; c、d都是氧化物;e是该元素的最高价
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a 是单质;b在通常状况下是气体; c、d都是氧化物;e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )
| A. | N2 | B. | C12 | C. | Si | D. | C |
13.在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如表:
①试判断K1>K2(填写“>”,“=”或“<”)
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.单位时间内,消耗1molN2的同时生成2mol NH3 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变.
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.单位时间内,消耗1molN2的同时生成2mol NH3 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变.
7.设NA为阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 46gC2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA | |
| C. | 将15.6gNa2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| D. | 2molSO2和1molO2混合,所得气体的分子数为2NA |
14.25℃、1.01×105Pa,下列哪个反应放出的热量表示乙炔的燃烧热(单位:kj•mol-1)( )
| A. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g) | B. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(1) | ||
| C. | C2H2(g)+$\frac{3}{2}$O2(g)=2CO2(g)+H2O(g) | D. | C2H2(g)+$\frac{3}{2}$O2(g)=2CO(g)+H2O(1) |
11.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:

(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出.
(2)表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水是因为温度越低,碳酸氢钠的溶解度越小,便于析出.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液的洗气装置,其作用是除去CO2中混合的HCl气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.

(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出.
(2)表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液的洗气装置,其作用是除去CO2中混合的HCl气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.
12.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体.在同温、同压下,两容器内的气体一定具有相同的是( )
| A. | 原子数 | B. | 相对分子质量 | C. | 质量 | D. | 密度 |