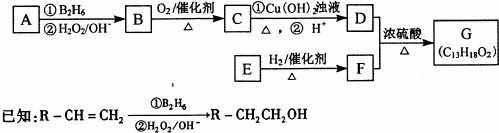
题目内容
足量的铜与浓硫酸反应,当反应停止后,加入下列物质后,铜又能继续溶解的是( )
①稀硫酸 ②氧化铁 ③铁 ④硝酸 ⑤硝酸钾.
①稀硫酸 ②氧化铁 ③铁 ④硝酸 ⑤硝酸钾.
| A、②④⑤ | B、①④⑤ |
| C、③④ | D、③④⑤ |
考点:铜金属及其重要化合物的主要性质,硝酸的化学性质,铁盐和亚铁盐的相互转变
专题:元素及其化合物
分析:浓硫酸与铜反应,在随着反应的进行,硫酸浓度逐渐降低,稀硫酸与铜不反应,如使铜溶解,可加入在酸性条件下具有强氧化性的物质,例如三价铁离子,硝酸或硝酸根等以此解答.
解答:
解:浓硫酸与铜反应,在随着反应的进行,硫酸浓度逐渐降低,稀硫酸与铜不反应,
①加入稀硫酸,仍然不反应,故①不可以;
②加入氧化铁,氧化铁会与剩余的硫酸反应生成三价铁,三价铁再氧化铜单质,故②可以;
③加入铁,铁会与剩余的硫酸反应生成二价铁,二价铁与铜单质不反应,故③不可以;
④加入硝酸,铜片能溶于稀硝酸中,发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故④可以;
⑤加入硝酸钾,相当于在剩余的稀硫酸中加入硝酸钾后,溶液中存在H+和NO3-,相当于稀硝酸,铜片能溶于稀硝酸中,发生发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故⑤可以.
故选A.
①加入稀硫酸,仍然不反应,故①不可以;
②加入氧化铁,氧化铁会与剩余的硫酸反应生成三价铁,三价铁再氧化铜单质,故②可以;
③加入铁,铁会与剩余的硫酸反应生成二价铁,二价铁与铜单质不反应,故③不可以;
④加入硝酸,铜片能溶于稀硝酸中,发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故④可以;
⑤加入硝酸钾,相当于在剩余的稀硫酸中加入硝酸钾后,溶液中存在H+和NO3-,相当于稀硝酸,铜片能溶于稀硝酸中,发生发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故⑤可以.
故选A.
点评:本题考查铜、硝酸的化学性质,设计新颖,针对性强,注重答题的灵活性,属于中等难度试题的考查.掌握物质的性质是解题的关键,另外还要注意在酸性环境下硝酸根具有强氧化性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在一定条件下,Na2S溶液存在水解平衡:S2-+H2O═HS-+OH-.下列说法正确的是( )
| A、稀释溶液,水解平衡常数增大 | ||
| B、通入H2S,HS-浓度增大 | ||
C、升高温度,
| ||
| D、加入NaOH固体,溶液pH减小 |
在一支盛有稀硫酸的试管加入适量铜粉,铜粉不溶,但加入下列试剂铜粉会溶的是( )
①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3.
①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3.
| A、①②③④ | B、①③④ |
| C、①④ | D、以上都不对 |
 阿斯巴甜具有清爽的甜味,其结构简式如图所示.下列关于阿斯巴甜的说法中,不正确的是( )
阿斯巴甜具有清爽的甜味,其结构简式如图所示.下列关于阿斯巴甜的说法中,不正确的是( )| A、一定条件下可以发生酯化反应和加成反应 |
| B、完全水解,生成两种有机物 |
| C、阿斯巴甜属于糖类化合物 |
| D、在酸性条件下可以水解生成两种氨基酸 |
下列实验过程中产生的变化与对应的图形相符合的是( )
A、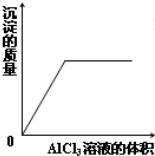 AlCl3溶液滴入NaOH溶液中 |
B、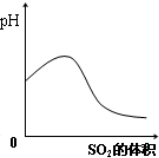 SO2气体通入氢硫酸中 |
C、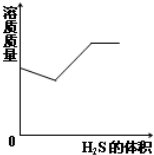 H2S气体通入NaOH溶液中 |
D、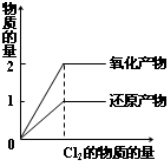 在一定量的H2S水溶液中逐渐通入Cl2 |
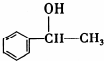 所示.
所示.