题目内容
 阿斯巴甜具有清爽的甜味,其结构简式如图所示.下列关于阿斯巴甜的说法中,不正确的是( )
阿斯巴甜具有清爽的甜味,其结构简式如图所示.下列关于阿斯巴甜的说法中,不正确的是( )| A、一定条件下可以发生酯化反应和加成反应 |
| B、完全水解,生成两种有机物 |
| C、阿斯巴甜属于糖类化合物 |
| D、在酸性条件下可以水解生成两种氨基酸 |
考点:有机物分子中的官能团及其结构
专题:有机物的化学性质及推断
分析:有机物中含有肽键,可发生水解或取代反应,含有酯基,可发生水解或取代反应,含有羧基,具有酸性,可发生中和和酯化反应,以此解答.
解答:
解:A.分子中含有羧基,可发生酯化反应,含有苯环,可发生加成反应,故A正确;
B.分子中含-COOC-、-CONH-,均能水解,则完全水解产生三种有机物,故B错误;
C.不具有多羟基醛或多羟基酮的结构,不属于糖类物质,故C错误;
D.分子中含有肽键和酯基,可在酸性条件下水解,水解生成两种氨基酸,故D正确.
故选BC.
B.分子中含-COOC-、-CONH-,均能水解,则完全水解产生三种有机物,故B错误;
C.不具有多羟基醛或多羟基酮的结构,不属于糖类物质,故C错误;
D.分子中含有肽键和酯基,可在酸性条件下水解,水解生成两种氨基酸,故D正确.
故选BC.
点评:本题考查有机物的结构与性质,注意把握有机物的官能团与性质的关系,题目难度不大,熟悉酯、蛋白质、氨基酸的性质即可解答.

练习册系列答案
相关题目
下列各选项所述的两个量中,前者一定小于后者的是( )
| A、纯水在25℃和100℃时的pH |
| B、CH3COONa溶液中Na+和CH3COO-的浓度 |
| C、相同温度下,0.1 mol/LCH3COOH溶液和0.3 mol/LCH3COOH溶液的电离平衡常数 |
| D、用0.1 mol/LNaOH溶液分别中和pH、体积均相同的盐酸和醋酸,所消耗NaOH溶液的体积 |
下列说法不正确的是( )
| A、可用铁氰酸钾溶液检验硫酸亚铁铵溶液中的亚铁离子 |
| B、可用淀粉溶液检验海带灰浸出液中的碘元素 |
| C、可用纸层析法分离铁离子与铜离子,分离时,蓝色斑点在棕色斑点的下方,说明铜离子在固定相中分配得更多 |
| D、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离方法 |
足量的铜与浓硫酸反应,当反应停止后,加入下列物质后,铜又能继续溶解的是( )
①稀硫酸 ②氧化铁 ③铁 ④硝酸 ⑤硝酸钾.
①稀硫酸 ②氧化铁 ③铁 ④硝酸 ⑤硝酸钾.
| A、②④⑤ | B、①④⑤ |
| C、③④ | D、③④⑤ |
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN) |
| B、a mol?L-1HCN溶液与b mol?L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、0.1 mol?L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D、NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
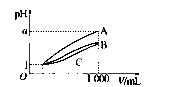 pH=1的三种酸溶液A、B、C各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的三种酸溶液A、B、C各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A、溶液的物质的量浓度C>B>A |
| B、酸性A>B>C |
| C、若a=4,则A是强酸,B、C是弱酸 |
| D、若1<a<4,则A、B、C都是弱酸 |
下列变化中,不可能通过一步反应实现的是( )
| A、Cu→CuSO4 |
| B、Fe→FeCl3 |
| C、NH3→NO |
| D、SiO2→H2SiO3 |
下列物质中,不能与盐酸反应的是( )
| A、Cu |
| B、Fe2O3 |
| C、Fe(OH)3 |
| D、Al |
