题目内容
17.下列关于化学用语的表述正确的是( )| A. | HF的电子式: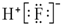 | |
| B. | H、D、T是氢元素的三种不同核素,互称同位素 | |
| C. | K+离子的结构示意图: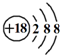 | |
| D. | 溴化钠的电子式: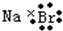 |
分析 A.氟化氢是共价化合物;
B.H、D、T质子数相同,中子数不同;
C.钾离子核内有19个质子;
D.溴化钠为离子化合物,由钠离子和溴离子构成.
解答 解:A.氟化氢的电子式为 ,故A错误;
,故A错误;
B.H、D、T质子数相同,中子数不同,故互为同位素,故B正确;
C.钾离子核内有19个质子,离子的结构示意图: ,故C错误;
,故C错误;
D.溴化钠为离子化合物,由钠离子和溴离子构成,电子式为 ,故D错误.
,故D错误.
故选B.
点评 本题考查化学用语,涉及电子式、同位素、原子结构示意图等,把握化学用语的区别及规范应用为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
7.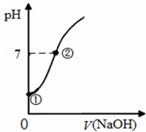 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在次氯酸的电离平衡 | |
| B. | ②点所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的电离程度逐渐减小 |
8.几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
| A. | Z的氢化物的稳定性强于L的氢化物的稳定性 | |
| B. | Y与Q形成的化合物不能跟氢氧化钠溶液反应 | |
| C. | 等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多 | |
| D. | 在化学反应中,M原子与其他原子易形成共价键而不易形成离子键 |
5.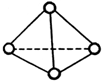 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )| A. | 1molN4气体转化为N2时要吸收206kJ能量 | |
| B. | N4是一种新型化合物 | |
| C. | 1molN4气体转化为N2时要放出740kJ能量 | |
| D. | N4是N2的同位素 |
2.下列关于0.5mol•L-1NaHCO3溶液的说法正确的是( )
| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 加水稀释后,n(H+)与n(OH-)的乘积变大 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
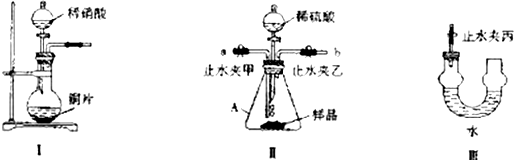
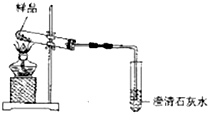
9.用下列实验装置进行相应实验,能达到实验目的是( )
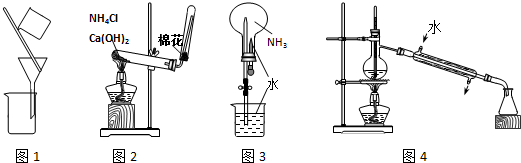

| A. | 用图1装置分离乙醇和乙酸 | B. | 用图2装置制取氨气 | ||
| C. | 用图3装置进行氨气的喷泉实验 | D. | 用图4装置进行石油的分馏实验 |
6.判断下列元素中不属于主族元素的是( )
| A. | 钡 | B. | 铅 | C. | 碘 | D. | 铁 |