题目内容
2.下列关于0.5mol•L-1NaHCO3溶液的说法正确的是( )| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 加水稀释后,n(H+)与n(OH-)的乘积变大 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
分析 A、碳酸氢钠完全电离出钠离子和碳酸氢根离子;
B、加水稀释,水电离出的氢离子和氢氧根离子的物质的量会增加;
C、在溶液中存在电荷守恒,根据电荷守恒的书写方法来回答;
D、碳酸钠中碳酸根离子会发生水解,升高温度,水解程度增加.
解答 解:A、碳酸氢钠完全电离出钠离子和碳酸氢根离子,电离方程式为:NaHCO3=Na++HCO3-,故A错误;
B、加水稀释,水电离出的氢离子和氢氧根离子的物质的量会增加,所以溶液中n(H+)与n(OH-)的乘积变大,故B正确;
C、在溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D、碳酸钠中碳酸根离子会发生水解,升高温度,水解程度增加,所以c(HCO3-)减小,故D错误.
故选B.
点评 本题考查学生物质的电离方程式的书写、盐的水解平衡移动以及水的电离平衡等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 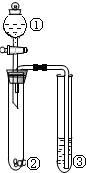 |
| A | 稀盐酸 | 石灰石 | 稀的碳酸钠溶液 | 溶解度:碳酸钠>碳酸氢钠 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸有脱水性、强氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | 浓硫酸具有强氧化性 | |
| D | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 酸性:盐酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
10.向21.6g Fe3O4、Fe2O3、FeO、Cu的混合物中加入0.5mol•L-1的硫酸溶液420mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A. | 1.12 g | B. | 2.24 g | C. | 3.36 g | D. | 6.40 g |
17.下列关于化学用语的表述正确的是( )
| A. | HF的电子式: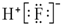 | |
| B. | H、D、T是氢元素的三种不同核素,互称同位素 | |
| C. | K+离子的结构示意图: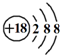 | |
| D. | 溴化钠的电子式: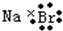 |
12.已知相同温度下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+):c(NH3•H2O)始终减小 | |
| C. | c(CH3COOH)与c(CH3COO?)之和始终保持不变 | |
| D. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-) |
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
 请回答:
请回答: