题目内容
15.关于电化学内容,下列说法正确的是( )| A. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| B. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
分析 A.碱性条件下的氢氧燃料电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应;
B.电解时阳极上阴离子失电子;
C.电解精炼时粗铜作阳极;
D.钢铁发生电化学腐蚀,Fe在负极失电子.
解答 解:A.碱性条件下的氢氧燃料电池中,负极上的电极反应式为:H2-2e-+2OH-=2H2O,故A错误;
B.电解时阳极上阴离子失电子,即氯离子失电子生成氯气,则阳极的电极反应式为:2Cl--2e-═Cl2↑,故B正确;
C.电解精炼时粗铜作阳极,粗铜与电源正极相连,电极反应式为Cu-2e-═Cu2+,故C错误;
D.钢铁发生电化学腐蚀,Fe在负极失电子,负极反应式:Fe-2e-═Fe2+,故D错误;
故选B.
点评 本题考查原电池和电解池原理,明确阴阳极和正负极上的反应类型是解本题的关键,侧重于基础知识的考查,注意钢铁的电化学腐蚀.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
5.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 0.5mol/LNaHSO4与0.5mol/LBa(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
6.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )
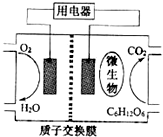

| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L |
20.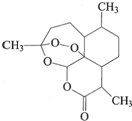 中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )
中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )
 中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )
中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 易溶于乙醚等有机溶剂 | |
| C. | 可发生取代反应,不能发生氧化反应 | |
| D. | 在强酸或强碱性溶液中不能稳定存在 |
7.下列晶体熔化时不需要破坏化学键的是( )
| A. | 金刚石 | B. | 氟化镁 | C. | 冰 | D. | 金属钾 |
4.有关金属晶体的说法不正确的是( )
| A. | 金属Cu的晶体的配位数为12 | |
| B. | 金属键是金属阳离子与自由电子间的相互作用 | |
| C. | 金属的延展性可以用电子气理论解释 | |
| D. | 金属Mg、Zn、Ti都是六方最密堆积,空间利用率是68% |

 ;D元素在元素周期表中的位置为第四周期第Ⅷ族
;D元素在元素周期表中的位置为第四周期第Ⅷ族