题目内容
2.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶有一种溶质,则上述四种离子浓度的大小顺序为①(填序号);
(2)若四种离子的关系符合③,则溶质为NH4Cl和NH3•H2O;若四种离子的关系符合④,则溶质为NH4Cl和HCl;
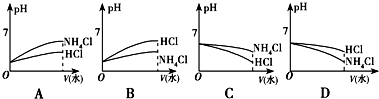
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是B(填图象符号).
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)小于c(NH3•H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)大于c(OH-).
分析 (1)任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
(2)由③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液;由④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液;
(3)pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,盐酸为强电解质,则pH变化程度大,而稀释时促进氯化铵中铵根离子水解,则pH变化小;
(4)体积相等稀盐酸和氨水混合,若浓度相等,则恰好完全反应生成氯化铵,溶液显酸性,则溶液恰好呈中性时应为氨水与氯化铵的混合溶液来分析;
解答 解:(1)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合,
故答案为:①;
(2)③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液,
其溶质为NH4Cl、NH3.H2O;④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,
故答案为:NH4Cl和NH3•H2O;NH4Cl和HCl;
(3)pH相同的NH4Cl溶液和HCl溶液稀释时氢离子的浓度都变小,则pH都变大,但盐酸为强电解质,则pH变化程度大,而氯化铵水解显酸性,稀释促进水解,氢离子浓度减小的倍数小于盐酸中氢离子浓度的变化,则pH变化小,只有B符合题意,
故答案为:B;
(4)因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为氯化铵,溶液显酸性,而该溶液恰好呈中性,则应为氨水与氯化铵的混合溶液,即c(HCl)<c(NH3•H2O),
而HCl为强电解质,完全电离,NH3.H2O为弱电解质,不完全电离,则混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)>c(OH-),
故答案为:小于;大于;
点评 本题难度中等,考查学生利用离子的关系来分析溶液中的溶质,明确溶液中的电离和水解是解答本题的关键,并注意(3)、(4)是学生解答的难点,与强酸、弱酸的稀释相似.

| A. | 环己烷的实验式:CH2 | B. | 四氯化碳分子的球棍模 型: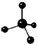 | ||
| C. | HCl的电子式: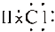 | D. | 氟原子的结构示意图: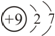 |
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA |
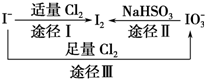 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )| A. | 可用KI-淀粉试纸和食醋检验加碘盐中是否含有碘 | |
| B. | 足量Cl2能使湿润的KI-淀粉试纸变白的原因可能是:5Cl2+I2+6H2O═2HIO3+10HCl | |
| C. | 由图可知氧化性的强弱顺序为Cl2>I2>IO${\;}_{3}^{-}$ | |
| D. | 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为5NA |

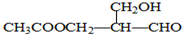 在有机物的分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
在有机物的分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )