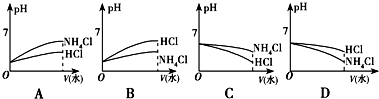
题目内容
7.A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示:已知G在生产中可作为一种耐火材料,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素,其中I+B→A+G属于置换反应.(部分反应物、生成物没有列出).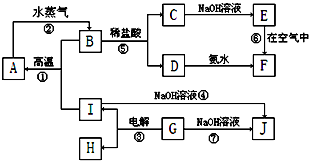
请填写下列空白:
(1)如何检验D中阳离子取一定量的D溶液于试管中,滴加适量的KSCN溶液,若溶液出现血红色,则说明含Fe3+.
(2)写出反应②的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,写出反应⑦的离子方程式:Al2O3+2OH-═2AlO2-+H2O
(3)E在空气中变成F的实验现象是白色沉淀迅速变为灰绿色最后变为红褐色.
(4)计算该反应中若转移2mol电子,需要标况下的O211.2L.
(5)将等质量的铜、锌、铁三种金属混合物a g加入盐酸和D的溶液中,充分反应后:
①若无固体剩余,则溶液中的阳离子一定有Zn2+、Cu2+、Fe2+,可能有H+、Fe3+;
②若剩余固体为$\frac{a}{3}$g,则溶液中的阳离子一定有Zn2+、Fe2+,可能有H+,一定没有Cu2+、Fe3+.
分析 F是红褐色难溶于水的沉淀,则F是Fe(OH)3,E在空气中被氧化生成氢氧化铁,则E是Fe(OH)2,C和氢氧化钠溶液反应生成氢氧化亚铁,根据元素守恒知,C中含有亚铁离子,D和氨水反应生成氢氧化铁,则D中含有铁离子,B和盐酸反应生成亚铁离子、铁离子,则B为Fe3O4,A和水蒸气反应生成四氧化三铁,则A是Fe,I+B→A+G属于置换反应,且该反应在高温条件下反应,则为铝热反应,所以I是Al,G是Al2O3,电解氧化铝生成铝和氧气,所以H是O2,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,所以J是NaAlO2,然后结合元素化合物知识来解答.
解答 解:F是红褐色难溶于水的沉淀,则F是Fe(OH)3,E在空气中被氧化生成氢氧化铁,则E是Fe(OH)2,C和氢氧化钠溶液反应生成氢氧化亚铁,根据元素守恒知,C中含有亚铁离子,D和氨水反应生成氢氧化铁,则D中含有铁离子,B和盐酸反应生成亚铁离子、铁离子,则B为Fe3O4,A和水蒸气反应生成四氧化三铁,则A是Fe,I+B→A+G属于置换反应,且该反应在高温条件下反应,则为铝热反应,所以I是Al,G是Al2O3,电解氧化铝生成铝和氧气,所以H是O2,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,所以J是NaAlO2,
(1)D为氯化铁溶液,铁离子和氢氧根离子反应生成红褐色沉淀,和硫氰化钾溶液反应生成血红色溶液,所以可以用氢氧化钠或硫氰化钾溶液检验铁离子,其操作方法是:取一定量的D溶液于试管中,滴加适量的KSCN溶液,若溶液出现血红色,则说明含Fe3+,
故答案为:取一定量的D溶液于试管中,滴加适量的KSCN溶液,若溶液出现血红色,则说明含Fe3+;
(2)②铁和水蒸气发生氧化还原反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
⑦氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子反应方程式为:Al2O3+2OH-═2AlO2 -+H2O,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;Al2O3+2OH-═2AlO2 -+H2O;
(3)E是白色的氢氧化亚铁,F是红褐色的氢氧化铁,白色的氢氧化亚铁不溶于水,也不稳定,易被空气中氧气氧化而迅速变为灰绿色,最后变化红褐色,
故答案为:白色沉淀迅速变为灰绿色最后变为红褐色;
(4)由转移电子的方向和数目为
(5)还原性Zn>Fe>Cu,氧化性为Fe3+>H+,
①氯化铁能溶解铜、锌、铁,而盐酸只能溶解锌、铁;又因为三种金属性强弱顺序是Zn>Fe>Cu,所以若无固体剩余,则溶液中的阳离子一定有Zn2+、Cu2+、Fe2+、H+;可能还含有铁离子、H+,
故答案为:Zn2+、Cu2+、Fe2+;H+、Fe3+;
②若剩余固体为$\frac{a}{3}$g,由于金属还原性:Zn>Fe>Cu,则剩余的固体一定为铜,则溶液中的阳离子一定有Zn2+、Fe2+;而一定没有Cu2+、Fe3+,H+可能含有,也可能没有,
故答案为:Zn2+、Fe2+;H+;Cu2+、Fe3+.
点评 本题考查无机物的推断,为高频考点,把握红褐色沉淀F为氢氧化铁、G为氧化铝及元素化合物知识为解答的关键,侧重分析与推断能力的考查,综合性较强,注意氧化还原反应的应用,题目难度中等.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si.
| A. | 只有②④ | B. | 只有①③ | C. | 只有①②③④ | D. | ①②③④⑤ |
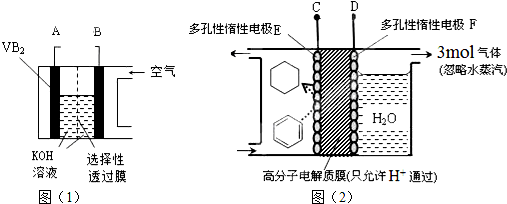
| A. | 整套装置工作时的连接为A连接D、B连接C | |
| B. | VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O | |
| C. | 电极F产生3mol气体时电极E得到的氧化产物为2mol | |
| D. | 储氢装置工作时,右侧电极区的pH值减小2×10-9 |
| A. | 铝片放入氢氧化钠溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| B. | Na与水反应:Na+2H2O═Na++H2↑+2OH- | |
| C. | 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | AlCl3溶液中滴入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
①CH2OH(CHOH)4CHO
②CH3CH2CH2OH
③CH2═CH-CH2OH
④CH2═CH-COOCH3
⑤CH2═CH-COOH.
| A. | ③⑤ | B. | ②④ | C. | ①③⑤ | D. | ①③ |
 的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |