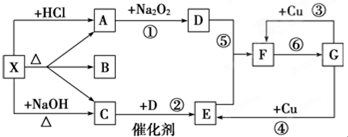
题目内容
2.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑩十种元素在周期表中的位置.| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | =10 ⑩ |
 ,①⑥⑦中原子半径最小的是C (填元素符号).
,①⑥⑦中原子半径最小的是C (填元素符号).(2)元素④和⑨的气态氢化物中较稳定的物质是
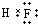 (填电子式)
(填电子式)(3)⑤和⑨能以离子 (填化学键类型)键结合形成离子 (填晶体类型)晶体,溶解时破坏离子键 (填作用力类型).
(4)⑧和⑨离子的还原性比较⑧大于 ⑨(填大于、小于),最高价氧化物对应水化物的酸性更强的物质是HClO4 (填化学式)
分析 由元素在周期表中的位置可知,①为C,②为N,③为O,④为F,⑤为Mg,⑥为Al,⑦为Si,⑧为S,⑨为Cl,⑩为Ar,
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体化学性质最不活泼;元素④为F,原子序数为9,核外含有3个电子层,据此画出其原子结构示意图;电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小;
(2)元素非金属性越强,对应氢化物越稳定;
(3)二者形成的混合物为氯化镁,氯化镁为离子化合物,含有的化学键为离子键,形成的晶体为离子晶体;离子晶体溶解时破坏的化学键为离子键;
(4)非金属性越强,对应离子的还原性越弱;非金属性越强,再根据氧化物对应水合物的酸性越强.
解答 解:由元素在周期表中的位置可知,①为C,②为N,③为O,④为F,⑤为Mg,⑥为Al,⑦为Si,⑧为S,⑨为Cl,⑩为Ar.
(1)稀有气体氩的化学性质最不活泼,同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中,金属性最强的元素是Mg;
元素④为F,其原子序数为9,其原子结构示意图为: ;
;
①⑥⑦三种元素中,原子的电子层最少的为C,其原子半径最小,
故答案为:氩;Mg;F2; ;C;
;C;
(2)非金属性F>Cl,非金属性越强,对应氢氧化物越稳定,故HF比HCl稳定,HF为共价化合物,分子中存在1个F-H共价键,氟化氢的电子式为: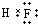 ,
,
故答案为: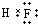 ;
;
(3)⑤为Mg,⑨为Cl,二者形成的混合物为氯化镁,氯化镁是以离子键形成的离子晶体,氯化镁溶解时破坏的是离子键,
故答案为:离子;离子;离子键;
(4)⑧和⑨分别为S、Cl,非金属性:Cl>S,则离子还原性:⑧大于⑨;非金属性越强,最高价氧化物对应水合物的酸性越强,则酸性最强的为:HClO4,
故答案为:大于; HClO4.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,明确元素周期表结构为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

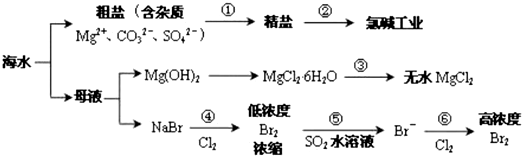
| A. | 过程①除杂的顺序:NaOH 溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O 灼烧即可制得无水 MgCl2 | |
| C. | 在过程④、⑥反应中每氧化 0.2 mol Br- 需消耗2.24 LCl2 | |
| D. | 从第④步到第⑥步的目的是为了富集溴 |
| A. | Li是负极,电极反应为Li-e-═Li+ | |
| B. | 锂电池属于一次性电池 | |
| C. | MnO2是正极,电极反应为MnO2+e-═MnO${\;}_{2}^{-}$ | |
| D. | 锂电池是一种环保型电池 |
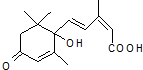 农艺师对盆栽施用S-诱抗素剂(分子结构如图),可以使鲜花按时盛开.下列说法不正确的是( )
农艺师对盆栽施用S-诱抗素剂(分子结构如图),可以使鲜花按时盛开.下列说法不正确的是( )| A. | S-诱抗素的分子式为C15 H20 O4 | |
| B. | S-诱抗素既能发生加聚反应,又能发生缩聚反应 | |
| C. | 1 mol S-诱抗素最多能和含1 mol NaOH的水溶液发生反应 | |
| D. | S-诱抗素既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
①铜与浓硝酸反应;
②铜与稀硝酸反应;
③铜先跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应.
以下叙述中正确的是( )
| A. | 消耗铜的物质的量相等 | B. | 消耗硝酸的物质的量相等 | ||
| C. | 消耗铜的物质的量是①>②>③ | D. | 消耗硝酸的物质的量是①>②>③ |