题目内容
12.下列物质间的反应属于吸热反应的是( )| A. | 甲烷在氧气中燃烧 | B. | 氢氧化钠溶液与盐酸的反应 | ||
| C. | 氢氧化钡晶体与氯化铵晶体的反应 | D. | 铝与氧化铁在高温条件下的反应 |
分析 反应物的总能量小于生成物的总能量为吸热反应,结合常见的吸热反应(大多数的分解反应、有C参加的氧化还原反应、氯化铵与氢氧化钡的反应等)来解答.
解答 解:A.甲烷燃烧放出大量的热量,为放热反应,故A不选;
B.酸碱中和反应,放出大量的热,为放热反应,故B不选;
C.氢氧化钡晶体与氯化铵晶体的反应为吸热反应,可观察到烧杯底部结冰,故C选;
D.铝与氧化铁在高温条件下的反应为铝热反应,属于放热反应,故D不选.
故选C.
点评 本题考查吸热反应与放热反应,为高频考点,注意常见的反应中的能量变化为解答的关键,注意归纳常见的吸热反应,侧重归纳与知识应用能力的考查,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
2.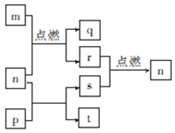 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:Z>Y | |
| B. | 化合物p中只存在离子键 | |
| C. | 图示转化关系涉及的反应均为氧化还原反应 | |
| D. | 最简单气态氢化物的稳定性:W>X |
3.下列粒子属于等电子体的是( )
| A. | CO和N2 | B. | CH4和NH4+ | C. | NH2-和H2O2 | D. | HCl和H2O |
20.下列说法正确的是( )
| A. | SiO2不能与HNO3、H2SO4等所有的酸反应 | |
| B. | 由Na2CO3+SiO$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑可知硅酸的酸性比碳酸的酸性强 | |
| C. | 硅胶常用于做干燥剂 | |
| D. | CO2与SiO2均是酸性氧化物,溶于水均得到相应的酸 |
7.一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)?PCl3(g)+Cl2(g)
反应过程中测定的部分数据见表(反应过程中条件不变):
请回答下列问题:
(1)x 的值是0.2;
(2)0-50s 内,用PCl3的浓度变化表示的化学反应速率是0.0016mol/(L•s);
(3)250s 以后,Cl2的物质的量不再改变的原因是250s达到平衡,正逆反应速率相等,条件不变,各组分的物质的量都不再变化;
(4)250s 时,容器中Cl2的物质的量是0.2mol,PCl5的物质的量是0.8mol,PCl5的转化率是20%.
反应过程中测定的部分数据见表(反应过程中条件不变):
| t/s | 0 | 30 | 150 | 250 | 350 | 450 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x |
(1)x 的值是0.2;
(2)0-50s 内,用PCl3的浓度变化表示的化学反应速率是0.0016mol/(L•s);
(3)250s 以后,Cl2的物质的量不再改变的原因是250s达到平衡,正逆反应速率相等,条件不变,各组分的物质的量都不再变化;
(4)250s 时,容器中Cl2的物质的量是0.2mol,PCl5的物质的量是0.8mol,PCl5的转化率是20%.
17.欲除去下列物质中混有的少量杂质(括号内物质为杂质),错误的是( )
| A. | 苯(苯酚):氢氧化钠溶液,充分震荡静止后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入氢氧化钠溶液,充分震荡静止后,分液 | |
| D. | 乙酸(乙醇):加入金属钠,蒸馏 |
 (1)在一定条件下N2与H2反应生成NH3,请回答:
(1)在一定条件下N2与H2反应生成NH3,请回答: