题目内容
7.一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)?PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变):
| t/s | 0 | 30 | 150 | 250 | 350 | 450 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x |
(1)x 的值是0.2;
(2)0-50s 内,用PCl3的浓度变化表示的化学反应速率是0.0016mol/(L•s);
(3)250s 以后,Cl2的物质的量不再改变的原因是250s达到平衡,正逆反应速率相等,条件不变,各组分的物质的量都不再变化;
(4)250s 时,容器中Cl2的物质的量是0.2mol,PCl5的物质的量是0.8mol,PCl5的转化率是20%.
分析 向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)?PCl3(g)+Cl2(g),由图表可知,反应进行到250s后 n(PCl3)的物质的量不再随时间的变化而变化,说明此时反应达到平衡状态,各组分的物质的量不再随时间的变化而变化,再结合速率的计算公式v=$\frac{△c}{△t}$计算用PCl3的浓度变化表示的化学反应速率,根据转化率=$\frac{△n}{{n}_{始}}$×100%计算PCl5的转化率即可.
解答 解:(1)反应进行到250s时达到平衡状态,在条件不变的情况下,各组分的物质的量都不再变化,n(PCl3)始终保持0.2mol,则x为0.2,故答案为:0.2;
(2)0-30s 内,用PCl3的浓度变化表示的化学反应速率为:$\frac{\frac{0.16mol}{2L}}{50s}$=0.0016mol/(L•s),故答案为:0.0016mol/(L•s);
(3)250s 达到平衡,正逆反应速率相等,条件不变,各组分的物质的量都不再变化,则250s 以后,Cl2的物质的量不再改变,故答案为:250s 达到平衡,正逆反应速率相等,条件不变,各组分的物质的量都不再变化;
(4)PCl5(g)?PCl3(g)+Cl2(g)
起始物质的量(mol) 1 0 0
变化物质的量(mol) 0.2 0.2 0.2
平衡物质的量(mol) 0.8 0.2 0.2
则:250s 时,容器中Cl2的物质的量是0.2mol,PCl5的物质的量是0.8mol,PCl5的转化率是$\frac{0.2mol}{1mol}×100%$=20%,
故答案为:0.2mol;0.8mol;20%.
点评 本题是考查平衡状态的建立与平衡的特征,涉及反应速率及转化率的计算,为基础考查,难度一般.

| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | C. | 镁与稀硫酸反应 | D. | 氧化钙溶于水 |
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②⑤ |
| A. | 甲烷在氧气中燃烧 | B. | 氢氧化钠溶液与盐酸的反应 | ||
| C. | 氢氧化钡晶体与氯化铵晶体的反应 | D. | 铝与氧化铁在高温条件下的反应 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
(2)B单质和C单质的化学性质相似,试写出C单质与强碱溶液反应的离子方程式Be+2OH-=BeO22-+H2↑;
(3)D和E组成的两种化合物中具有漂白性的是SO2,该化合物转化为另一种化合物的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3 ;
(4)已知A的氢化物能与水反应生成一种可燃性气体和一种强碱,试写出该反应的化学方程式NaH+H2O=NaOH+H2↑.
 是一种由三种α-氨基酸分子脱水缩合生成的五肽的结构简式,这种五肽彻底水解时,不可能产生的氨基酸是( )
是一种由三种α-氨基酸分子脱水缩合生成的五肽的结构简式,这种五肽彻底水解时,不可能产生的氨基酸是( )



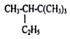 的系统命名为2,2,3,-三甲基戊烷;
的系统命名为2,2,3,-三甲基戊烷;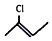 表示的分子式为C4H7Cl;
表示的分子式为C4H7Cl; .
.