题目内容
15. (1)在一定条件下N2与H2反应生成NH3,请回答:
(1)在一定条件下N2与H2反应生成NH3,请回答:①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为放热(填“吸热”或“放热”)反应.
②已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1.
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量:2H2O2(l)=O2(g)+2H2O(l)△H=-196.4kJ/mol.反应N2H4(g)+O2(g)=N2(g)+2H2O(l)的△H=-621.2kJ/mol.N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方段式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ•mol-1.
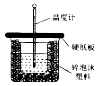
(3)实验室用50mL0.50mol/L盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为环形玻璃搅拌棒;实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应选择0.55mol/L的溶液进行实验.
分析 (1)①反应物总能量大于生成物总能量,为放热反应;
②化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(2)先写出液态联氨燃烧的热化学方程式,然后根据盖斯定律来解答;
(3)根据量热计的构造来判断该装置的缺少仪器;为了使反应充分,NaOH应过量.
解答 解:(1)①反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为放热反应,故答案为:放热;
②在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1;
(2)16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量,热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-621.2 kJ•mol-1①
2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ•mol-1 ②
根据盖斯定律,①+②得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ•mol-1 ,
故答案为:-621.2;N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ•mol-1 ;
(3)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;实验室提供了0.50mol•L-1和0.55mol•L-1两种浓度的NaOH溶液,为了使反应充分,NaOH应过量,所以选择0.55mol•L-1的溶液进行实验,
故答案为:环形玻璃搅拌棒;0.55.
点评 本题考查热化学方程式的书写,热反应热的测定,题目难度大,注意理解测定反应热的原理.

 阅读快车系列答案
阅读快车系列答案| A. | 甲烷在氧气中燃烧 | B. | 氢氧化钠溶液与盐酸的反应 | ||
| C. | 氢氧化钡晶体与氯化铵晶体的反应 | D. | 铝与氧化铁在高温条件下的反应 |
| A. | 电解饱和食盐水制得Cl2 | B. | 电解熔融MgCl2制得金属Mg | ||
| C. | 高温下CO还原赤铁矿可用于炼铁 | D. | 电解熔融AlCl3制得金属Al |
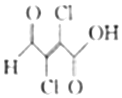 粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示.下列有关粘氯酸的说法不正确的是( )
粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示.下列有关粘氯酸的说法不正确的是( )| A. | 分子式为C4H2Cl2O3 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol粘氯酸与足量NaHCO3溶液反应,能产生标准状况下22.4LCO2 | |
| D. | 粘氯酸与足量H2反应生成M,则含一个甲基的M的同分异构体只有3种 |
| 选项 | a | b | c | 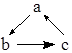 |
| A | Cu | CuO | Cu(OH)2 | |
| B | SiO2 | Na2SiO3 | H2SiO3 | |
| C | AlCl3 | NaAlO2 | Al(OH)3 | |
| D | CaO | Ca(OH)2 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
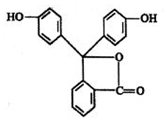 酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图:
酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图: