题目内容
13.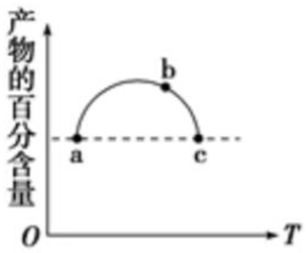 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )| A. | a、b、c三点均为平衡点 | |
| B. | a、c两点的反应速率相同 | |
| C. | b点对应温度的平衡常数大于c点对应温度的平衡常数 | |
| D. | a、c两点体系的压强相同 |
分析 在恒容容器中充入一定量的SO2和Cl2,随着温度的升高,反应趋于平衡,由图象可知,最高点应为平衡状态,升高温度,产物的百分含量逐渐降低,说明平衡逆向移动,以此解答该题.
解答 解:A.由图象可知,最高点以后(包括b、c)为平衡状态,a不是平衡状态,故A错误;
B.a、c两点的温度不同,则反应速率不同,故B错误;
C.b、c都为平衡状态,升高温度生成物含量减小,说明升高温度平衡逆向移动,则温度越高,平衡常数越小,故C正确;
D.a、c两点的温度不同,则压强不同,故D错误.
故选C.
点评 本题考查了百分含量随温度变化的曲线、化学平衡的影响因素,题目难度不大,注意掌握外界条件对化学平衡的影响,正确分析图象中曲线变化为解答本题的关键,试题培养了学生分析、理解图象信息的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.既可以用来鉴别乙烯和甲烷,又可以用来除去甲烷中混有的乙烯的最好方法是( )
| A. | 点燃 | B. | 与酸性高锰酸钾溶液反应 | ||
| C. | 通入足量的溴水 | D. | 在催化剂存在的条件下与氢气反应 |
3.测定CuSO4•xH2O晶体的x值,数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( )
| 坩埚质量 | 坩埚+试样 | 失水后,坩埚+试样 |
| 11.70g | 20.82g | 16.50g |
| A. | 晶体中含不挥发杂质 | B. | 未做恒重操作 | ||
| C. | 加热前晶体未研磨 | D. | 加热时有晶体溅出 |
 有四种物质:①氧化铝 ②稀硫酸 ③碳酸氢钠 ④氢氧化钠
有四种物质:①氧化铝 ②稀硫酸 ③碳酸氢钠 ④氢氧化钠