题目内容
5.金属钠通常保存在煤油,取黄豆粒大小的金属钠,用滤纸擦干其表面的煤油,然后投入到硫酸铜溶液中,可观察到:钠浮(填“沉”或“浮”)在液面,迅速产生气体,同时有蓝色的不溶物生成.分析 金属钠能和氧气、水反应,故应隔绝空气和水保存;钠的密度比水小,据此分析投入溶液中的现象;钠投入硫酸铜溶液中后,先和水反应生成NaOH和氢气,然后NaOH再和硫酸铜反应,据此分析现象.
解答 解:金属钠能和氧气、水反应,故应隔绝空气和水保存,实验室中金属钠通常保存在煤油中;钠的密度比水小,故投入到硫酸铜溶液中后,金属钠浮在液面上,和水剧烈反应生成NaOH和氢气,然后NaOH再和硫酸铜反应:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,故有蓝色沉淀生成.故答案为:煤油;浮;蓝.
点评 本题考查了金属钠和盐溶液的反应和其与水密度的相对大小,应注意的是将钠投入盐溶液中后,钠先和水反应,生成的氢氧化钠再和盐反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.将一小块金属钠放在坩埚里加热,实验现象描述正确的是( )
①钠在燃烧之前先熔化 ②钠燃烧的火焰呈紫色
③钠燃烧后得到白色固体 ④钠燃烧的火焰呈黄色
⑤钠燃烧后生成物为淡黄色固体.
①钠在燃烧之前先熔化 ②钠燃烧的火焰呈紫色
③钠燃烧后得到白色固体 ④钠燃烧的火焰呈黄色
⑤钠燃烧后生成物为淡黄色固体.
| A. | ①④⑤ | B. | 只有⑤ | C. | 只有① | D. | ②③ |
18.最近全面通车的沪昆高速铁路是国家重要的交通线路,在工程建设中用量最大的硅酸盐材料是( )
| A. | 钢筋 | B. | 水泥 | C. | 玻璃 | D. | 陶瓷 |
13.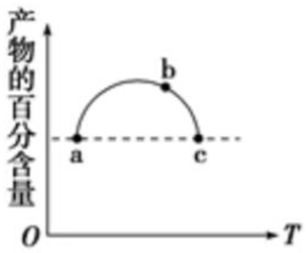 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )| A. | a、b、c三点均为平衡点 | |
| B. | a、c两点的反应速率相同 | |
| C. | b点对应温度的平衡常数大于c点对应温度的平衡常数 | |
| D. | a、c两点体系的压强相同 |
20.下列说法正确的是( )
| A. | 硫酸的摩尔质量是98g | |
| B. | 1mol O2的质量是32g•mol-1 | |
| C. | 2g氢气含有氢原子的物质的量是2mol | |
| D. | 64g Fe的物质的量是1mol |
17.甲、乙、丙分别是FeSO4、NaOH、BaCl2三种物质中的一种,若将甲溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀不消失;若将丙溶液滴入乙溶液中,发现有白色沉淀生成;丙溶液滴入甲溶液时,无明显现象发生.据此可推断乙物质是( )
| A. | 无法确定 | B. | NaOH | C. | BaCl2 | D. | FeSO4 |
14.下列离子方程式正确的是( )
| A. | 硫化钠溶液显碱性:S2-+H2O═HS-+OH- | |
| B. | 硫酸铜溶液呈酸性:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| C. | 氯化铝溶液与碳酸钠溶液混合:Al3++CO32-═Al(OH)3↓+H2↑ | |
| D. | 在饱和氯化铵溶液中撒入镁粉后微热:2NH4++Mg═Mg2++2NH3↑+H2↑ |
15.下列说法不正确的是( )
| A. | 用酚酞溶液可区别苯酚钠溶液与福尔马林 | |
| B. | 用溴水可区别丙烯与丙烯酸 | |
| C. | 用新制的Cu(OH)2悬浊液可区别醋酸与乙醇 | |
| D. | 无法用溴水除去苯中溶有的少量苯酚 |