题目内容
2.已知0.1mol/L NaHB溶液的pH=2,则0.1mol/L H2B溶液中c(H+)<0.11mol/L(填“>”“<”“=”).原因是H2B第一步电离产生的H+对HB-的电离起了抑制作用HB-?H++B2-的电离平衡常数是K=$\frac{c({H}^{+})•c({B}^{2-})}{c(H{B}^{-})}$.分析 若0.1mol•L-1NaHB溶液的pH=2,说明溶液中C(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步完全电离,第二步部分电离,且含有相同的离子能抑制弱根离子的电离;根据电离平衡常数的概念解答.
解答 解:若0.1mol•L-1NaHB溶液的pH=2,说明溶液中C(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步完全电离,第二步部分电离,由于H2B第一步电离产生的H+抑制了HB-的电离,故H2B(0.1 mol/L)的c(H+)小于0.11 mol/L;
HB-?H++B2-的电离平衡常数为:K=$\frac{c({H}^{+})•c({B}^{2-})}{c(H{B}^{-})}$,
故答案为:<;H2B第一步电离产生的H+对HB-的电离起了抑制作用;K=$\frac{c({H}^{+})•c({B}^{2-})}{c(H{B}^{-})}$.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确电离平衡及其影响因素为解答关键,注意掌握电离平衡常数的概念及表达式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.当光束通过下列分散系时,可观察到丁达尔效应的是( )
| A. | 硫酸铜溶液 | B. | 氢氧化铁胶体 | C. | 蔗糖溶液 | D. | 氯化钠溶液 |
13.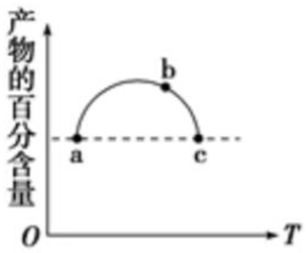 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )| A. | a、b、c三点均为平衡点 | |
| B. | a、c两点的反应速率相同 | |
| C. | b点对应温度的平衡常数大于c点对应温度的平衡常数 | |
| D. | a、c两点体系的压强相同 |
17.甲、乙、丙分别是FeSO4、NaOH、BaCl2三种物质中的一种,若将甲溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀不消失;若将丙溶液滴入乙溶液中,发现有白色沉淀生成;丙溶液滴入甲溶液时,无明显现象发生.据此可推断乙物质是( )
| A. | 无法确定 | B. | NaOH | C. | BaCl2 | D. | FeSO4 |
7.在恒容密闭容器中充入2mol气体X和3mol气体Y发生反应:2X(g)+3Y(g)?4Z(g)△H=-akJ•mol-1,达到平衡时,下列描述一定正确的是( )
| A. | 各物质的浓度之比c(X):c(Y):c(Z)=2:3:4 | B. | 消耗2molX,同时消耗4molZ | ||
| C. | 混合气体的密度保持不变 | D. | 反应放出akJ热量 |
14.下列离子方程式正确的是( )
| A. | 硫化钠溶液显碱性:S2-+H2O═HS-+OH- | |
| B. | 硫酸铜溶液呈酸性:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| C. | 氯化铝溶液与碳酸钠溶液混合:Al3++CO32-═Al(OH)3↓+H2↑ | |
| D. | 在饱和氯化铵溶液中撒入镁粉后微热:2NH4++Mg═Mg2++2NH3↑+H2↑ |
12.在相同条件下0.1mol/L的氢氧化钠溶液和0.1mol/L的盐酸中,水的电离程度( )
| A. | 一样大 | B. | 后者大 | C. | 前者大 | D. | 无法确定 |