题目内容
2.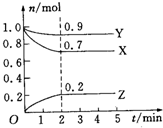 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示,下列说法中不正确的是( )
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示,下列说法中不正确的是( )| A. | 该反应的化学方程式为3X+Y?2Z | |
| B. | 反应到达平衡状态时,X的转化率为70% | |
| C. | 反应开始到2min,Z的平均反应速率为0.05mol•L-1•min-1 | |
| D. | 为提高X的转化率,可适当增加Y的浓度 |
分析 A.先根据X、Y、Z的物质的量变化情况判断反应物、生成物及计量数之比,从而可形成反应的化学方程式;
B.平衡时X的物质的量变化为:n(X)=1.0mol-0.7mol=0.3mol,初始物质的量为1.0mol,据此可计算出X的转化率;
C.根据v=$\frac{\frac{△n}{V}}{△t}$计算出反应开始到2min时用Z的平均反应速率;
D.增加一种反应物浓度,可以增大另一种反应物的转化率.
解答 解:A.平衡时X、Y、Z的物质的量变化分别为:n(X)=1.0mol-0.7mol=0.3mol,n(Y)=1.0mol-0.9mol=0.1mol,n(Z)=0.2mol,其物质的量之比分别为0.3mol:0.1mol:0.2mol=3:1:2,该反应的化学方程式为:3X+Y?2Z,故A正确;
B.平衡时X的物质的量变化为:n(X)=1.0mol-0.7mol=0.3mol,则X的转化率为:$\frac{0.3mol}{1.0mol}$×100%=30%,故B错误;
C.反应开始到2min,Z的平均反应速率为:v(Z)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol•L-1•min-1,故C正确;
D.适当增加Y的浓度,平衡向着正向移动,则有利于提高X的转化率,故D正确;
故选B.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握转化率、化学反应速率的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
12.下列有机物常温下呈液态的是( )
| A. | CH3(CH2)2CH3 | B. | CH3(CH2)15CH3 | C. | CHCl3 | D. | CH3Cl |
13.下列化学用语正确的是( )
| A. | 氯化氢的电子式 | B. | 镁的原子结构示意图 | ||
| C. | 乙酸的结构简式C2H4O2 | D. | HClO的结构式H-Cl-O |
10.T℃时,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),发生反应:2SO2(g)+O2(g)?2SO3(g),5min时甲达到平衡.其起始量及SO2的平衡转化率如下表所示.下列叙述不正确的是( )
| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,甲、丙中气体密度分别为ρ1、ρ2,则ρ2>2ρ1 | |
| D. | 平衡时,SO2的转化率:α1<80%<α2 |
17.将FeO与Cu(NO3)2的混合物9.08g全部溶于300mL、1mol/L的盐酸中,有部分Fe2+被酸性条件下的NO3-氧化(其化学反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O),放出NO气体448mL(标准状况);继续向溶液中通入一定量的Cl2恰好将溶液中的Fe2+完全氧化;再加入10g过量的铁粉,充分反应放出H2,过滤,得到不溶固体.下列叙述不正确的是( )
| A. | Cu(NO3)2的物质的量为0.01mol | B. | 通入Cl2的体积(标准状况)为448mL | ||
| C. | 放出H2的体积(标准状况)为112mL | D. | 得到不溶固体的质量为6.72g |
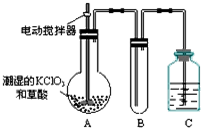 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.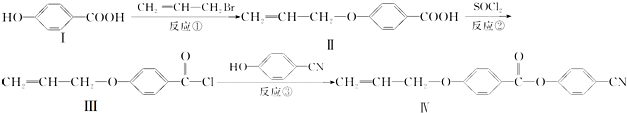
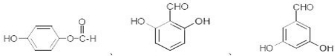 .
.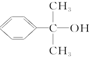 也可与化合物Ⅲ发生类
也可与化合物Ⅲ发生类 .
.