题目内容
5.我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出.该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法.I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成.
①该反应的离子方程式为2CuFeS2+17H2O2+2 H+═2Cu2++2Fe3++4SO42-+18H2O.
②该反应在25-50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为H2O2受热分解,产物Cu2+、Fe3+催化H2O2分解等.
Ⅱ.配位浸出
反应原理:CuFeS2+NH3•H2O+O2+OH-→Cu(NH3)42++Fe2O3+SO42-+H2O(未配平)
(2)为提高黄铜矿的浸出率,可采取的措施提高氨水的浓度、提高氧压(其他合理答案也可给分)(.
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4C1,构成NH3•H2O-NH4Cl缓冲溶液.某小组在实验室对该缓冲体系进行了研究:25℃时,向a mol•L-1的氨水中缓慢加入等体积0.02mol•L-1的NH4C1溶液,平衡时溶液呈中性.则NH3•H2O的电离常数Kb=$\frac{2×1{0}^{-9}}{a}$(用含a的代数式表示);滴加NH4C1溶液的过程中水的电离平衡正向(填“正向”、“逆向”或“不”)移动.
Ⅲ.生物浸出在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示.
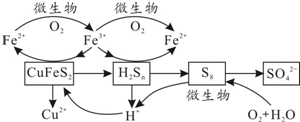
(4)在微生物的作用下,可以循环使用的物质有Fe2(SO4)3、H2SO4(或Fe3+、H+)(填化学式),微生物参与的离子反应方程式为4Fe2++O2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$4Fe3++2H2O或S8+12O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$8SO42-+16H+任写一个(任写一个).
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2mol SO42-生成时,理论上消耗O2的物质的量为4.25mol.
分析 I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成.
①酸性条件下,双氧水和黄铜矿反应生成铜离子、铜离子、硫酸根离子和水;
②双氧水不稳定,受热易分解生成水和氧气,且铜离子、铁离子能促进双氧水分解;
Ⅱ.配位浸出
(2)为提高黄铜矿的浸出率,可采取的措施有增大反应物浓度或增大压强;
(3)25℃时,向a mol•L-1的氨水中缓慢加入等体积0.02mol•L-1的NH4C1溶液,平衡时溶液呈中性,
则溶液中c(H+)=c(OH-)=10-7 mol/L,根据电荷守恒得c(NH4+)=c(Cl-)=0.01mol/L,
则NH3•H2O的电离常数Kb=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$;
含有弱离子的盐促进水电离;
Ⅲ.(4)由图知Fe2(SO4)3、H2SO4是中间产物;
(5)铁元素最终全部转化为Fe3+,硫元素转化为硫酸根,根据得失电子守恒计算.
解答 解:(1)①酸性条件下,双氧水和黄铜矿反应生成铜离子、铜离子、硫酸根离子和水,离子方程式为2CuFeS2+17H2O2+2 H+═2Cu2++2Fe3++4SO42-+18H2O,
故答案为:2CuFeS2+17H2O2+2 H+═2Cu2++2Fe3++4SO42-+18H2O;
②双氧水不稳定,受热易分解生成水和氧气,且铜离子、铁离子能促进双氧水分解,导致实际生产中双氧水的消耗量要远远高于理论值,
故答案为:H2O2受热分解、产物Cu2+、Fe3+催化H2O2分解等;
(2)为提高黄铜矿的浸出率,可采取的措施有增大反应物浓度或增大压强,所以可以通过提高氨水浓度、提高氧压来实现,故答案为:提高氨水的浓度、提高氧压(其他合理答案也可给分);
(3)25℃时,向a mol•L-1的氨水中缓慢加入等体积0.02mol•L-1的NH4C1溶液,平衡时溶液呈中性,
则溶液中c(H+)=c(OH-)=10-7 mol/L,根据电荷守恒得c(NH4+)=c(Cl-)=0.01mol/L,
则NH3•H2O的电离常数Kb=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{0.01×1{0}^{-7}}{\frac{a}{2}}$=$\frac{2×1{0}^{-9}}{a}$;
铵根能与氢氧根结合,促进水的电离,则水的电离平衡向正方向移动,
故答案为:$\frac{2×1{0}^{-9}}{a}$;正向;
(4)由图知Fe2(SO4)3、H2SO4是中间产物,可循环使用;微生物参与的离子方程式为4Fe2++O2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$4Fe3++2H2O或S8+12O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$8SO42-+16H+任写一个,
故答案为:Fe2(SO4)3、H2SO4(或Fe3+、H+);
4Fe2++O2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$4Fe3++2H2O或S8+12O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$8SO42-+16H+任写一个;
(5)铁元素最终全部转化为Fe3+,硫元素转化为硫酸根,当有2mol SO42-生成时,失去电子工17mol,消耗O2的物质的量为$\frac{17}{4}$mol=4.25mol,
故答案为:4.25 mol.
点评 本题考查物质分离和提纯,为高频考点,涉及方程式的有关计算、离子方程式书写、电离平衡常数的计算等知识点,明确反应原理、物质性质及离子方程式书写规则是解本题关键,难点是一水合氨电离平衡常数的计算.

 阅读快车系列答案
阅读快车系列答案| A. | 食盐溶液 | B. | 氯化钙溶液 | C. | 苏打水 | D. | 饱和氯水 |
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
| A. | 放出248 kJ 热量 | B. | 吸收248 kJ 热量 | C. | 放出183kJ 热量 | D. | 吸收183 kJ 热量 |
| A. | 氯化氢的电子式 | B. | 镁的原子结构示意图 | ||
| C. | 乙酸的结构简式C2H4O2 | D. | HClO的结构式H-Cl-O |
| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,甲、丙中气体密度分别为ρ1、ρ2,则ρ2>2ρ1 | |
| D. | 平衡时,SO2的转化率:α1<80%<α2 |
| A. | Cu(NO3)2的物质的量为0.01mol | B. | 通入Cl2的体积(标准状况)为448mL | ||
| C. | 放出H2的体积(标准状况)为112mL | D. | 得到不溶固体的质量为6.72g |
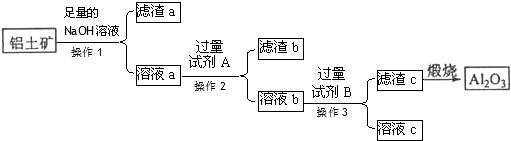
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.