题目内容
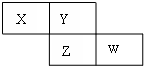 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A、气态氢化物的稳定性:X>Y |
| B、Z元素的氧化物对应的水化物一定是一种强酸 |
| C、X、Y、Z原子半径的大小顺序:X>Y>Z |
| D、X的气态氢化物与W的气态氢化物可以相互反应 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,Y原子只能有2个电子层,次外层电子数为2,最外层电子数为6,则Y为O元素,由图中的位置可知,X为N,Z为S,W为Cl,然后利用元素周期律及物质的性质来解答.
解答:
解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,Y原子只能有2个电子层,次外层电子数为2,最外层电子数为6,则Y为O元素,由图中的位置可知,X为N,Z为S,W为Cl,
A.同周期自左而右元素非金属性增强,氢化物稳定性增强,故氢化物稳定性:X<Y,故A错误;
B.Z为S元素,三氧化硫对应的水化物为硫酸,属于强酸,但二氧化硫对应的水化物是亚硫酸,属于弱酸,故B错误;
C.同周期从左向右原子半径在减小,电子层越多原子半径越大,则原子半径:Z>X>Y,
D.X的氢化物是氨气,W是氢化物是氯化氢,氨气和氯化氢反应生成氯化铵,故D正确;
故选D.
A.同周期自左而右元素非金属性增强,氢化物稳定性增强,故氢化物稳定性:X<Y,故A错误;
B.Z为S元素,三氧化硫对应的水化物为硫酸,属于强酸,但二氧化硫对应的水化物是亚硫酸,属于弱酸,故B错误;
C.同周期从左向右原子半径在减小,电子层越多原子半径越大,则原子半径:Z>X>Y,
D.X的氢化物是氨气,W是氢化物是氯化氢,氨气和氯化氢反应生成氯化铵,故D正确;
故选D.
点评:本题考查位置结构性质关系应用,正确推断元素是解答本题的关键,Y的结构是推断突破口,理解核外电子排布规律,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学用语正确的是( )
A、Cl-的结构示意图: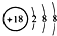 | ||
| B、光导纤维主要成分的化学式:Si | ||
| C、1H2、2H2、3H2互为同位素 | ||
D、质子数为53,中子数为78的碘原子:
|
2mol O3和2mol H2S相比较,下列叙述中正确的是( )
| A、摩尔质量相等 | B、原子数相等 |
| C、体积相等 | D、质量相等 |
已知:N2O4(g)?2NO2(g)△H=+52.70kJ?mol-1.在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是( )
| A、若再向容器内继续通入少量N2O4,则平衡向正反应方向移动 |
| B、新平衡时,NO2的体积分数小于原平衡时NO2的体积分数 |
| C、新平衡时,容器中气体的平均相对分子质量比原平衡大 |
| D、新平衡时,混合气体颜色变浅,容器中气体的密度增大 |
下列有关电解质溶液的叙述,不正确的是( )
| A、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 |
| B、在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
| C、在含有BaSO4沉淀的溶液中加入Na2SO4固体,溶液中c(Ba2+)减小 |
| D、常温下,pH=2的盐酸与pH=12的氨水等体积混合所得溶液c(H+)>c(OH-) |
常温下,已知0.1mol/L的NaX、NaY、NaZ溶液,其pH值分别为8、9、10,则HX、HY、HZ的酸性强弱排列正确的是( )
| A、HX>HY>HZ |
| B、HY>HX>HZ |
| C、HZ>HY>HX |
| D、HZ>HX>HY |
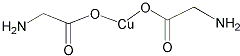
 某有机物的结构为如图,该有机物不可能具有的性质是( )
某有机物的结构为如图,该有机物不可能具有的性质是( )