题目内容
常温下,已知0.1mol/L的NaX、NaY、NaZ溶液,其pH值分别为8、9、10,则HX、HY、HZ的酸性强弱排列正确的是( )
| A、HX>HY>HZ |
| B、HY>HX>HZ |
| C、HZ>HY>HX |
| D、HZ>HX>HY |
考点:盐类水解的应用
专题:盐类的水解专题
分析:常温下,物质的量浓度相同的钠盐,弱酸根离子水解程度越大,其钠盐溶液pH越大,酸根离子水解程度越大,该酸的酸性越弱,据此判断酸的强弱.
解答:
解:常温下,物质的量浓度相同的钠盐,弱酸根离子水解程度越大,其钠盐溶液pH越大,酸根离子水解程度越大,该酸的酸性越弱,0.1mol/L的NaX、NaY、NaZ溶液,其pH值分别为8、9、10,则HX、HY、HZ的酸性强弱排列顺序为HX>HY>HZ,
故选A.
故选A.
点评:本题考查了盐类水解,明确酸的强弱与酸根离子水解程度大小关系即可解答,有时盐类水解还常常与离子浓度大小比较联合考查,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列说法中正确的一组是( )
| A、H2和D2互为同位素 |
B、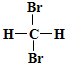 和 和 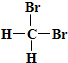 互为同分异构体 互为同分异构体 |
C、碳链为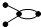 与 与 的烃为同系物 的烃为同系物 |
| D、金刚石、石墨互为同素异形体 |
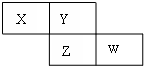 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A、气态氢化物的稳定性:X>Y |
| B、Z元素的氧化物对应的水化物一定是一种强酸 |
| C、X、Y、Z原子半径的大小顺序:X>Y>Z |
| D、X的气态氢化物与W的气态氢化物可以相互反应 |
t℃时,NaCl的溶解度为a g,取该温度下的饱和氯化钠溶液V mL,测得其密度为ρg/cm3,则下列表达式正确的是( )
A、w(NaCl)=
| ||
B、n(NaCl)=
| ||
C、c(NaCl)=
| ||
D、n(NaCl)=
|
能说明常温下二氧化硅是很坚硬的固体而二氧化碳是气体的原因是( )
| A、硅的非金属性比碳的活泼 |
| B、二氧化硅中硅氧键的类型和二氧化碳中碳氧键不同 |
| C、硅氧键的键能比碳氧键的键能大得多 |
| D、二氧化硅晶体类型和二氧化碳晶体不同 |
关于乙酸的酯化反应叙述正确的是( )
| A、属于氧化反应 |
| B、属于取代反应 |
| C、酸去氢,醇去羟基 |
| D、用饱和的氯化钠溶液吸收乙酸乙酯 |
对25℃时的醋酸溶液,若采用下列不同的措施:
(1)加入NaOH固体(2)加入CaCO3固体 (3)加等体积的水稀释 (4)加热醋酸溶液使温度上升10℃(5)加入醋酸钠晶体 (6)加入盐酸,其中能使醋酸电离度增大的有( )
(1)加入NaOH固体(2)加入CaCO3固体 (3)加等体积的水稀释 (4)加热醋酸溶液使温度上升10℃(5)加入醋酸钠晶体 (6)加入盐酸,其中能使醋酸电离度增大的有( )
| A、(1)(3)(4) |
| B、(1)(2)(3)(4) |
| C、(1)(3)(4)(5) |
| D、(1)(2)(3)(4)(5) |
容积固定的密闭容器中,达平衡的可逆反应2A(g)?2B+C (△H>0),若随着温度升高,气体平均相对分子质量减小,则下列判断正确的是( )
| A、B和C可能都是液体 |
| B、B和C肯定都是气体 |
| C、B和C可能都是固体 |
| D、若C为固体,则B一定是气体 |
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液480mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液480mL.根据这两种溶液的配制情况回答下列问题: