题目内容
下列有关电解质溶液的叙述,不正确的是( )
| A、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 |
| B、在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
| C、在含有BaSO4沉淀的溶液中加入Na2SO4固体,溶液中c(Ba2+)减小 |
| D、常温下,pH=2的盐酸与pH=12的氨水等体积混合所得溶液c(H+)>c(OH-) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.加水稀释醋酸,促进醋酸电离,醋酸中c(H+)减小;
B.如果醋酸和醋酸钠混合溶液呈中性,则c(Na+)=c(CH3COO-);
C.硫酸根离子抑制硫酸钡溶解;
D.常温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合,氨水有剩余.
B.如果醋酸和醋酸钠混合溶液呈中性,则c(Na+)=c(CH3COO-);
C.硫酸根离子抑制硫酸钡溶解;
D.常温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合,氨水有剩余.
解答:
解:A.加水稀释促进醋酸电离,醋酸电离程度增大,醋酸电离增大程度小于溶液体积增大程度,则溶液中c(H+)减小,则溶液的pH增大,故A正确;
B.如果醋酸和醋酸钠混合溶液呈中性,则c(H+)=c(HO-),根据电荷守恒得c(Na+)=c(CH3COO-),故B正确;
C.硫酸钡在水溶液中存在溶解平衡,向溶液中加入硫酸钠时,硫酸根离子浓度增大,则抑制硫酸钡溶解,所以溶液中c(Ba2+)减小,故C正确;
D.常温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合,氨水有剩余,溶液呈碱性,则c(H+)<c(OH-),故D错误;
故选D.
B.如果醋酸和醋酸钠混合溶液呈中性,则c(H+)=c(HO-),根据电荷守恒得c(Na+)=c(CH3COO-),故B正确;
C.硫酸钡在水溶液中存在溶解平衡,向溶液中加入硫酸钠时,硫酸根离子浓度增大,则抑制硫酸钡溶解,所以溶液中c(Ba2+)减小,故C正确;
D.常温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合,氨水有剩余,溶液呈碱性,则c(H+)<c(OH-),故D错误;
故选D.
点评:本题考查弱电解质的电离、难溶物的溶解平衡、酸碱混合溶液定性判断等知识点,知道弱电解质电离的影响因素、难溶物溶解平衡影响因素即可解答,注意A中加水稀释导致醋酸电离程度增大但电离平衡常数不变,题目难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案
相关题目
同温同压下,1molHe和1molCH4具有相同的( )
| A、原子数 | B、质子数 |
| C、质量 | D、体积 |
下列表达方式错误的是( )
| A、CO2分子的结构式:O=C=O | ||
B、S2-的结构示意图: | ||
C、中子数为10的氧原子符号:
| ||
D、NaBr的电子式 |
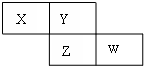 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A、气态氢化物的稳定性:X>Y |
| B、Z元素的氧化物对应的水化物一定是一种强酸 |
| C、X、Y、Z原子半径的大小顺序:X>Y>Z |
| D、X的气态氢化物与W的气态氢化物可以相互反应 |
下列说法中,错误的是( )
| A、键长越长,化学键越牢固 |
| B、成键原子间原子轨道重叠越多,共价键越牢固 |
| C、对双原子分子来讲,键能越大,含有该键的分子越稳定 |
| D、原子间通过共用电子对所形成的化学键叫共价键 |
能说明常温下二氧化硅是很坚硬的固体而二氧化碳是气体的原因是( )
| A、硅的非金属性比碳的活泼 |
| B、二氧化硅中硅氧键的类型和二氧化碳中碳氧键不同 |
| C、硅氧键的键能比碳氧键的键能大得多 |
| D、二氧化硅晶体类型和二氧化碳晶体不同 |
科学家经研究证实光可诱发下列化学变化:

这一事实可解释人眼的夜视功能.有关X、Y的叙述中错误的是( )

这一事实可解释人眼的夜视功能.有关X、Y的叙述中错误的是( )
| A、X和Y不互为手性异构 |
| B、X和Y的所有原子都可能处于同一平面内 |
| C、一定条件下X和Y都可与7molH2加成反应 |
| D、X和Y都易溶于水 |
下列各组物质反应后,滴入KSCN溶液一定显红色的是( )
| A、生了锈的铁块放入稀H2SO4中 |
| B、FeCl3、CuCl2的混合溶液中加入过量的铁粉 |
| C、FeO放入稀HNO3中 |
| D、Fe放入HNO3溶液中 |
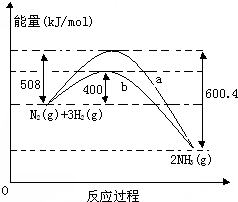 如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线.
如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线.