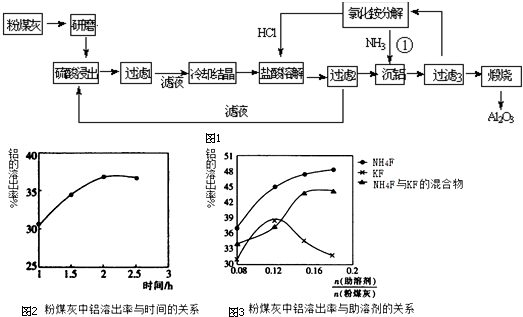
题目内容
17.海水淡化过程中,不涉及的方法是( )| A. | 萃取法 | B. | 电渗析法 | C. | 离子交换法 | D. | 蒸馏法 |
分析 海水淡化海水就是将海水中的可溶性杂质除去的过程,结合混合物分离提纯方法、原理来解答.
解答 解:A.对于微溶于水的有机物,可用萃取法,但海水淡化降低盐类物质得到蒸馏水,与萃取无关,故A选;
B.利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果,故不选;
C.通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的,故C不选;
D.蒸馏法是把水从海水中分离出来,得到纯净的水,故D不选;
故选A.
点评 本题考查混合物分离提纯及海水资源应用,为高频考点,把握混合物分离方法、原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 向水中通入少量的氯气:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Al2(SO4)3中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 碳酸氢氨溶液和过量NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑ |
5.根据表,下列说法正确的是( )
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ka=1.8×10-5 |
| H2SO3 | Ka1=1.23×10-2 Ka2=6.6×10-8 |
| NH3.H2O | Kb=1.8×10-5 |
| A. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的 | |
| B. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
2.下列关于元素周期表应用的说法正确的是( )
| A. | 在过渡元素中,可以找到半导体材料 | |
| B. | 在ⅠA、ⅡA族元素中,寻找制造农药的主要元素 | |
| C. | 在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料 | |
| D. | 为元素性质的系统研究提供指导,为新元素的发现提供线索 |
9.关于如图的说法不正确的是( )
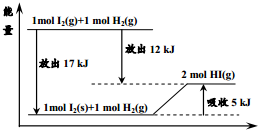

| A. | 1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量 | |
| B. | 2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量 | |
| C. | 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量 | |
| D. | 碘蒸气与H2生成HI气体的反应是吸热反应 |
6.下列设计的实验方案能达到实验目的是( )
| A. | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 | |
| B. | 室温下向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中少量苯酚 | |
| C. | 向无色的淀粉KI溶液中滴加少量氯水,溶液变成蓝色,说明氧化性:Cl2>I2 | |
| D. | 向含酚酞的氢氧化钠溶液中加入少量30%H2O2溶液,红色褪去,向褪色后的溶液再补加NaOH溶液,不显红色,说明H2O2因显酸性而使溶液褪色 |
7.下列叙述不正确的是( )
| A. | 离子化合物中可能存在非极性键 | |
| B. | 硫酸分子中有H+和SO42-两种离子 | |
| C. | 某原子的最外层只有一个电子,它与卤族元素可能形成离子键,也可能形成共价键 | |
| D. | 离子键和共价键的实质都是电性的相互作用 |
 (或
(或 、
、 ).
).